Mengyelejev periodikus rendszerének jelentése. A kémiai elemek periódusos rendszerének kémiai elemeinek nevének etimológiája D.I. Mengyelejev Csalólap a szervetlen kémiáról
Periódusos rendszer elemek nagy hatással voltak a kémia későbbi fejlődésére.
Dmitrij Ivanovics Mengyelejev (1834-1907)
Nemcsak a kémiai elemek első természetes osztályozása volt, amely megmutatta, hogy harmonikus rendszert alkotnak, és szoros kapcsolatban állnak egymással, hanem a további kutatások hatékony eszközévé is vált.
Abban az időben, amikor Mengyelejev az általa felfedezett periodikus törvény alapján összeállította táblázatát, sok elem még ismeretlen volt. Így a negyedik periódusos elem skandium ismeretlen volt. Atomtömegét tekintve a titán a kalcium után következett, de a titán nem kerülhetett közvetlenül a kalcium mögé, mert a harmadik csoportba kerülne, míg a titán magasabb oxidot képez, egyéb tulajdonságai szerint pedig a negyedik csoportba kell sorolni. . Ezért Mengyelejev kihagyott egy sejtet, vagyis szabad teret hagyott a kalcium és a titán között. Ugyanezen alapon a negyedik periódusban két szabad sejt maradt a cink és az arzén között, amelyeket most a gallium és a germánium elemek foglalnak el. Más sorokban még vannak üres helyek. Mengyelejev nemcsak arról volt meggyőződve, hogy léteznie kell még ismeretlen elemeknek, amelyek kitöltik ezeket a tereket, hanem előre megjósolta az ilyen elemek tulajdonságait a periódusos rendszer többi eleme között elfoglalt helyzetük alapján. Egyiküknek az ekabor nevet adta, amely a jövőben a kalcium és a titán között fog helyet foglalni (mivel tulajdonságait a bórhoz kellett hasonlítani); a másik kettő, amihez maradt az asztal szabad ülések a cink és az arzén között eca-alumíniumnak és eca-szilíciumnak nevezték el.
A következő 15 évben Mengyelejev jóslatai ragyogóan beigazolódtak: mindhárom várt elemet felfedezték. Először Lecoq de Boisbaudran francia vegyész fedezte fel a galliumot, amely az eka-alumínium összes tulajdonságával rendelkezik; majd Svédországban L. F. Nilsson felfedezte a szkandiumot, amely az ekaboron tulajdonságaival bír, végül néhány évvel később Németországban K. A. Winkler felfedezett egy általa germániumnak nevezett elemet, amelyről kiderült, hogy azonos az ekasiliconnal.
Mengyelejev előrelátásának elképesztő pontosságának megítéléséhez hasonlítsuk össze az eca-szilícium általa 1871-ben megjósolt tulajdonságait az 1886-ban felfedezett germánium tulajdonságaival:


A gallium, a szkandium és a germánium felfedezése volt a periodikus törvény legnagyobb diadala.
Nagy érték periodikus rendszerrel rendelkezett egyes elemek vegyértékének és atomtömegének megállapításában is. Így a berillium elemet régóta az alumínium analógjának tekintik, és ennek oxidját jelölték ki a képletnek. A berillium-oxid százalékos összetétele és várható képlete alapján atomtömegét 13,5-nek tekintettük. A periódusos rendszer kimutatta, hogy a táblázatban csak egy hely van a berilliumnak, mégpedig a magnézium felett, ezért oxidjának a képletnek kell lennie, amely a berillium atomtömege tíz. Ezt a következtetést hamarosan megerősítették a berillium atomtömegének meghatározása a klorid gőzsűrűségéből.
Pontosan És jelenleg is a periodikus törvény marad a kémia vezérfonala és vezérelve. Ennek alapján az elmúlt évtizedekben mesterségesen hozták létre az urán után a periódusos rendszerben elhelyezkedő transzurán elemeket. Az egyiket - a 101-es számú elemet, amelyet először 1955-ben szereztek meg - a nagy orosz tudós tiszteletére mendeleviumnak nevezték el.
A periodikus törvény felfedezése és a kémiai elemek rendszerének megalkotása nemcsak a kémia, hanem a filozófia, a világ egész megértése szempontjából is nagy jelentőséggel bírt. Mengyelejev megmutatta, hogy a kémiai elemek harmonikus rendszert alkotnak, amely a természet alapvető törvényén alapul. Ez a materialista dialektika természeti jelenségek összekapcsolódásáról és egymásra utaltságáról alkotott álláspontjának kifejezése. A kémiai elemek tulajdonságai és atomjaik tömege közötti összefüggést feltárva a periodikus törvény ragyogóan megerősítette a természet fejlődésének egyik univerzális törvényét - a mennyiség minőségbe való átmenetének törvényét.
A tudomány ezt követő fejlődése lehetővé tette a periodikus törvény alapján az anyag szerkezetének sokkal mélyebb megértését, mint Mengyelejev életében lehetséges volt.
A 20. században kialakult atomszerkezet-elmélet pedig új, mélyebb megvilágítást adott a periodikus törvénynek és az elemek periodikus rendszerének. Mengyelejev prófétai szavai ragyogóan beigazolódtak: „Az időszakos törvényt nem fenyegeti a pusztulás, de csak felépítményt és fejlesztést ígérnek.”
Az elemek periódusos rendszere volt a kémiai elemek első természetes osztályozása, amely megmutatta, hogy egymással összefüggésben állnak, és a további kutatások alapjául is szolgált.
Amikor Mengyelejev az általa felfedezett periodikus törvény alapján összeállította táblázatát, sok elem még ismeretlen volt. Mint például a 4. periódus három eleme. Feltehetően az elemeket ekaboronnak (tulajdonságai a bórhoz kell hasonlítani), ekaaluminumnak, ecasiliciumnak nevezték. 15 éven belül Mengyelejev jóslatai beigazolódtak. francia vegyész Lecoq de Boisbaudran felfedezték a galliumot, amely az eka-alumínium összes tulajdonságával rendelkezik, L.F. Nilson felfedezett skandiumot, és K.A. Winkler felfedezte a germánium elemet, amely az eca-szilícium tulajdonságaival rendelkezik.
A Ga, Sc, Ge felfedezése a periodikus törvény létezésének bizonyítéka. A periódusos rendszernek nagy jelentősége volt egyes elemek vegyértékének és atomtömegének megállapításában, némelyikük korrekciójában is. A transzurán elemek immár a periódusos törvény alapján jöttek létre.
munka vége -
Ez a téma a következő részhez tartozik:
Szervetlen kémia csalólap
Csalólap a szervetlen kémiáról. Olga Vladimirovna Makarova..
Ha további anyagra van szüksége ebben a témában, vagy nem találta meg, amit keresett, javasoljuk, hogy használja a munkaadatbázisunkban található keresést:
Mit csinálunk a kapott anyaggal:
Ha ez az anyag hasznos volt az Ön számára, elmentheti az oldalára a közösségi hálózatokon:
| Csipog |
Az összes téma ebben a részben:
Az anyag és mozgása
Az anyag egy objektív valóság, amelynek mozgási tulajdonsága van. Minden, ami létezik, különböző típusú mozgó anyagok. Az anyag a tudattól függetlenül létezik
Anyagok és változásaik. A szervetlen kémia tárgya
Az anyagok olyan típusú anyagok, amelyek különálló részecskéi véges nyugalmi tömeggel rendelkeznek (kén, oxigén, mész stb.). A fizikai testek anyagokból állnak.
Minden
Elemek periódusos rendszere D.I. Mengyelejev
A periodikus törvényt 1869-ben fedezte fel D.I. Mengyelejev. Létrehozta a kémiai elemek osztályozását is, periodikus rendszer formájában kifejezve. Do Me
A kémiai szerkezet elmélete
A kémiai szerkezet elméletét A.M. Butlerov A következő rendelkezéseket tartalmazza: 1) a molekulák atomjai kapcsolódnak egymáshoz
A P-, S-, D-elemek általános jellemzői
A Mengyelejev-féle periódusos rendszer elemei s-, p-, d-elemekre vannak osztva. Ez a felosztás az alapján történik, hogy egy elem atomjának elektronhéja hány szinttel rendelkezik
Kovalens kötés. Vegyérték kötés módszer
Nem poláris és poláris kovalens kötések
A kémiai kötések segítségével az anyagokban lévő elemek atomjait egymás közelében tartják. A kémiai kötés típusa a molekulában lévő elektronsűrűség eloszlásától függ.
Többközpontú kommunikáció
A vegyértékkötés módszerének kidolgozása során világossá vált, hogy a molekula valós tulajdonságai köztesnek bizonyulnak a megfelelő képlettel leírtak között. Az ilyen molekulák
Ionos kötés
Egy kötés, amely élesen kifejezett ellentétes tulajdonságú atomok között jött létre (egy tipikus fém és egy tipikus nemfém), amelyek között elektrosztatikus vonzási erők lépnek fel
Hidrogén kötés
A 80-as években a XIX. M.A. Iljinszkij és N.N. Beketov megállapította, hogy a hidrogénatom fluor-, oxigén- vagy nitrogénatommal kombinálva képes képződni
Energiaátalakítás kémiai reakciókban
A kémiai reakció egy vagy több kiindulási anyag átalakulása más anyagokká az anyag kémiai összetételének vagy szerkezetének megfelelően.
A nukleáris reakciókhoz képest
Láncreakciók
Vannak kémiai reakciók, amelyekben az összetevők közötti kölcsönhatás egészen egyszerűen megtörténik. Nagyon nagy csoportja van a reakcióknak, amelyek összetett módon fordulnak elő. Ezekben a reakciókban
A nemfémek általános tulajdonságai
A nemfémek Mengyelejev periódusos rendszerében elfoglalt helyzete alapján azonosítani lehet jellemző tulajdonságaikat. Meghatározhatja az elektronok számát a külső en
Hidrogén
Hidrogén (H) – Mengyelejev periodikus rendszerének 1. eleme – I. és VII. csoport, fő alcsoport, 1. periódus. A külső s1 alszinten 1 vegyértékelektron és 1 s2 van
Hidrogén-peroxid
A peroxid vagy a hidrogén-peroxid a hidrogén (peroxid) oxigénvegyülete. Képlet: H2O2 Fizikai tulajdonságok: hidrogén-peroxid – színtelen szirup
A halogén alcsoport általános jellemzői
Halogének - a VII. csoport elemei - fluor, klór, bróm, jód, asztatin (radioaktivitása miatt az asztatint kevéssé tanulmányozták). A halogének különálló nemfémek. Csak jód re
Klór. Hidrogén-klorid és sósav
A klór (Cl) a 3. periódusban, a periódusos rendszer fő alcsoportjának VII. csoportjában, 17. sorszámú, atomtömege 35,453; halogénekre utal.
Rövid információ a fluorról, brómról és jódról
Fluor (F); bróm (Br); A jód (I) a halogének csoportjába tartozik. A periódusos rendszer fő alcsoportjának 7. csoportjába tartoznak. Általános elektronikus képlet: ns2np6.
Az oxigén alcsoport általános jellemzői
Az oxigén és tulajdonságai
Az oxigén (O) az 1. periódusban, a VI. csoportban, a fő alcsoportban található. p-elem. Elektronikus konfiguráció 1s22s22p4. Az elektronok száma a külső szinten
Az ózon és tulajdonságai
Szilárd állapotban az oxigénnek három módosulata van: ?-, ?– és ?– módosulás. Az ózon (O3) az oxigén egyik allotróp módosulata
A kén és tulajdonságai
A kén (S) a természetben vegyületekben és szabad formában is előfordul. Gyakoriak a kénvegyületek is, mint például az ólomfényű PbS, a cinkkeverék ZnS, a rézfényű Cu
Kénhidrogén és szulfidok
A hidrogén-szulfid (H2S) színtelen gáz, szúrós, rothadó fehérje szagú. A természetben megtalálható ásványforrásokban, vulkáni gázokban, rothadó hulladékokban és egyéb anyagokban
A kénsav tulajdonságai és gyakorlati jelentősége
A kénsav képletének felépítése: Előkészítés: A kénsav SO3-ból történő előállításának fő módja a kontakt módszer.
Kémiai tulajdonságok
1. A tömény kénsav erős oxidálószer. A redoxreakciók melegítést igényelnek, és a reakció terméke főként kén-dioxid.
Nyugta
1. Az iparban a nitrogént a levegő cseppfolyósításával nyerik, majd elpárologtatják, és elválasztják a nitrogént a levegő egyéb gázfrakcióitól. A keletkező nitrogén nemesgázok (argon) szennyeződéseit tartalmazza.
A nitrogén alcsoport általános jellemzői
A nitrogén alcsoport az ötödik csoport, a D.I. periódusos rendszerének fő alcsoportja. Mengyelejev. Tartalmazza a következő elemeket: nitrogén (N); foszfor (P); arzén (
Ammónia (nitrogén-klorid)
Előkészítés: az iparban a 19. század végéig a szén kokszolása során melléktermékként ammóniát nyertek, amely legfeljebb 1-2% nitrogént tartalmaz.
Elején
Ammónium sók
Az ammóniumsók összetett anyagok, amelyek NH4+ ammóniumkationokat és savas maradékokat tartalmaznak.
Fizikai tulajdonságok: ammóniumsók – t
Nitrogén-oxidok
Oxigénnel az N oxidokat képez: N2O, NO, N2O3 NO2, N2O5 és NO3. Nitrogén-monoxid I – N2O – dinitrogén-oxid, „nevetőgáz”. Fizikai tulajdonságok:
Salétromsav
A salétromsav színtelen, szúrós szagú, levegőben „füstölő” folyadék. Kémiai képlet HNO3.
Fizikai tulajdonságok Hőmérsékleten
A foszfor allotróp módosulatai
A foszfor számos allotróp módosulatot képez. A foszfor allotróp módosulásának jelenségét a különféle kristályformák kialakulása okozza. Fehér foszfo
A foszforsav-anhidrid több savnak felel meg. A fő a H3PO4 ortofoszforsav. A dehidratált foszforsav színtelen átlátszó kristályok formájában jelenik meg
Ásványi műtrágyák
Az ásványi műtrágyák szervetlen anyagok, főleg sók, amelyek a növények számára szükséges tápanyagokat tartalmazzák, és a termékenység növelésére szolgálnak.
A szén és tulajdonságai
A szén (C) egy tipikus nemfém; a periódusos rendszerben a IV. csoport 2. periódusában, a fő alcsoportban található. Sorozatszám 6, Ar = 12,011 amu, nukleáris töltés +6.
A szén allotróp módosulatai
A szén 5 allotrópot alkot: köbös gyémánt, hatszögletű gyémánt, grafit és kétféle karbin. Meteoritokban talált hatszögletű gyémánt (ásvány
Szén-oxidok. szénsav
A szén és az oxigén oxidokat képez: CO, CO2, C3O2, C5O2, C6O9 stb. Szén-monoxid (II) – CO. Fizikai tulajdonságok: szén-monoxid, b
A szilícium és tulajdonságai
A szilícium (Si) a periódusos rendszer fő alcsoportjának IV. csoportjában, a 3. periódusban található. Fizikai tulajdonságok: a szilícium két változatban létezik: amo
Az elsődleges részecskék belső szerkezetének három típusa van
1. A szuszpenzoidok (vagy irreverzibilis kolloidok) heterogén rendszerek, amelyek tulajdonságait a kialakult interfázis felület határozza meg. A szuszpenziókhoz képest jobban diszpergált
Kovasav sók
A kovasavak általános képlete n SiO2?m H2O A természetben főleg sók formájában találhatók meg, például HSiO (orthoc
Cement és kerámia gyártása
A cement a legfontosabb anyag az építőiparban. A cementet agyag és mészkő keverékének égetésével állítják elő. CaCO3 (szóda hamu) keverékének égetésekor
A fémek fizikai tulajdonságai
Minden fémnek számos közös, jellemző tulajdonsága van. Általános tulajdonságoknak tekintendők: nagy elektromos és hővezető képesség, plaszticitás.
A met paramétereinek változása
A fémek kémiai tulajdonságai
A fémek alacsony ionizációs potenciállal és elektronaffinitással rendelkeznek, ezért redukálószerként működnek a kémiai reakciókban és oldatokban képződnek
Fémek és ötvözetek a technológiában
A periódusos rendszerben a 110 ismert elem közül 88 fém. A 20. században nukleáris reakciók segítségével olyan radioaktív fémeket nyertek, amelyek nem léteznek
Fémek előállítási módjai
A természetben számos fém található vegyületek formájában. A natív fémek azok, amelyek szabad állapotban fordulnak elő (arany, platina, p
A fémek korróziója (korrózió - korrózió) a fémek és ötvözetek fizikai és kémiai reakciója a környezettel, melynek következtében elvesztik tulajdonságaikat. A szívében a
Fémek védelme a korrózió ellen
A fémek és ötvözetek korrózió elleni védelme agresszív környezetben a következőkön alapul: 1) magának az anyagnak a korrózióállóságának növelése; 2) az agresszivitás csökkentése
A lítium alcsoport általános jellemzői
A lítium alcsoportba – 1. csoport, a fő alcsoportba – az alkálifémek tartoznak: Li – lítium, Na – nátrium, K – kálium, Cs – cézium, Rb – rubídium, Fr – francium. Összes elektron
Nátrium és kálium
A nátrium és a kálium alkálifémek, és a fő alcsoport 1. csoportjába tartoznak.
Fizikai tulajdonságok: hasonló fizikai tulajdonságok: világos ezüst
Maró lúgok
A lúgok a fő alcsoport 1. csoportjába tartozó alkálifémek hidroxidjait képezik vízben oldva.
Fizikai tulajdonságok: a lúgok vizes oldatai szappanosak
Nátrium- és káliumsók
A nátrium és a kálium minden savval sókat képez. A nátrium- és káliumsók kémiai tulajdonságaikban nagyon hasonlóak. E sók jellemző tulajdonsága, hogy jó vízoldékonyságot mutatnak
A berillium alcsoport általános jellemzői
A berillium alcsoportba a berillium és az alkáliföldfémek tartoznak: magnézium, stroncium, bárium, kalcium és rádium. A természetben leggyakrabban vegyületek formájában,
Kalcium
A kalcium (Ca) a periódusos rendszer 2. csoportjának kémiai eleme, és egy alkáliföldfém elem. A természetes kalcium hat stabil izotópból áll. Konf
Kalcium-oxid és -hidroxid
A kalcium-oxid (CaO) – égetett mész vagy égetett mész – egy fehér, tűzálló anyag, amelyet kristályok képeznek. Arcközpontú köbös kristályokká kristályosodik
A víz keménysége és megszüntetésének módjai
Mivel a kalcium széles körben elterjedt a természetben, sói nagy mennyiségben megtalálhatók a természetes vizekben. A magnézium- és kalcium-sókat tartalmazó vizet ún
A bór alcsoport általános jellemzői
Az alcsoport összes elemének külső elektronikus konfigurációja s2p1. A IIIA alcsoport jellemző tulajdonsága a fémes tulajdonságok teljes hiánya a bórban és a ti-ben
Alumínium. Alumínium és ötvözeteinek alkalmazása
Az alumínium a fő alcsoport 3. csoportjában, a 3. periódusban található. Sorozatszám 13. Atomtömeg ~27. P-elem. Elektronikus konfiguráció: 1s22s22p63s23p1.On out
Alumínium-oxid és -hidroxid
A króm alcsoport elemei köztes helyet foglalnak el az átmenetifémek sorában. Magas olvadáspontjuk és forráspontjuk, szabad helyük van az elektronikán
Króm-oxidok és -hidroxidok
A króm három oxidot képez: CrO, Cr2O3 és CrO3. Króm-II oxid (CrO) – bázikus oxid – fekete por. Erős redukálószer. A CrO híg sósavban oldódik
Kromátok és dikromátok
A kromátok a H2Cr04 krómsav sói, amely csak vizes oldatokban fordul elő, koncentrációja nem haladja meg a 75%-ot. A króm vegyértéke a kromátokban 6. A kromátok olyanok
A vascsalád általános jellemzői
A vascsalád a nyolcadik csoport másodlagos alcsoportjának része, és az első hármas benne, beleértve a vasat, kobaltot, nikkelt
Vasvegyületek
A vas(II)-oxid FeO fekete kristályos anyag, vízben és lúgokban nem oldódik. A FeO a Fe(OH)2 bázisnak felel meg.
Domain folyamat
A nagyolvasztó eljárás a nyersvas olvasztása nagyolvasztó kemencében. A nagyolvasztó 30 m magas és 12 m belső átmérőjű tűzálló téglával van bélelve
Öntöttvas és acél
A vasötvözetek olyan fémrendszerek, amelyek fő összetevője a vas.
A vasötvözetek osztályozása: 1) vasötvözetek szénnel (n
Nehézvíz
A nehézvíz természetes izotóp összetételű oxigénes deutérium-oxid D2O, színtelen, szagtalan és íztelen folyadék.
Nehéz víz nyílt
Kémiai és fizikai tulajdonságok
A nehéz víz forráspontja 101,44 °C, olvadáspontja 3,823 °C.
A D2O kristályok szerkezete megegyezik a hagyományos jégkristályokéval, a különbség méretben van .
Sósav sói A sósav sói vagy kloridjai olyan klórvegyületek, amelyekben minden elem alacsonyabb elektronegativitással rendelkezik.
Fém-kloridok
Új anyagok tanulása
Dmitrij Ivanovics Mengyelejev
Ugyanez a probléma szembesült a középkor vegyészeivel is.
Abban az időben a tudósok, amint emlékeztek, alkimistáknak hívták őket, ismerték 10 kémiai elem - hét fém (arany, ezüst, réz, vas, ón, ólom és higany) és három nemfém (kén, szén és antimon).
Az alkimisták úgy vélték, hogy a kémiai elemek a csillagokhoz és a bolygókhoz kapcsolódnak, és asztrológiai szimbólumokat rendeltek hozzájuk.
Az aranyat Napnak hívták, és egy ponttal ellátott kör jelölte.A réz a Vénusz, ennek a fémnek a szimbóluma a „Vénusz tükör”. Az alkimisták nagyon sokáig nélkülözték a kémiai képleteket. Különös szimbólumok voltak használatban, szinte minden vegyész a saját jelölési rendszerét használta az anyagokra. Nagyon kényelmetlen volt. Valóságos zűrzavar volt: ugyanazokat a kémiai reakciókat különböző előjelekkel írták le. Be kellett lépni egységes rendszer jelölés.
A 18. században geometriai formák - körök, félkörök, háromszögek, négyzetek - formájában gyökeret vert az elemek kijelölő rendszere (amelyből ekkor már három tucat ismert volt).
A kémiai elemek jelenleg használt szimbólumait Jens Jakob Berzelius svéd kémikus vezette be.
Minden elemnek megvan a maga szimbóluma, amely bármely ország tudósa számára érthető. A szimbólum első, nagybetűje mindig az elem teljes latin nevének első betűje. Ha több elem neve ilyen betűvel kezdődik, akkor az elsőhöz egy másik betű kerül hozzáadásra.
Például: Oxygen – Oxуgenium – O
Szén – Carboneum – C
Kalcium – Kalcium – Ca
A karakterek kiejtése a latin ábécé betűi szerint történik.
Például: oxigén – O – „o”
nitrogén – N – „en”
Másokat oroszul olvasnak.
Például: kalcium – Ca – „kalcium”
Nátrium – Na – „nátrium”
Nem kell minden elemet memorizálnia. De további munkánkhoz számos elemet meg kell tanulnunk.
Mindegyik le van írva a 35. oldalon található tankönyvben. Minden elem felosztható fémekre és nemfémekre.
A kémiai elemek nevének etimológiája:
Tekintsük a kémiai elemek nevének etimológiáját, i.e. nevük eredete.
A név egy egyszerű anyag legfontosabb tulajdonságát tükrözi, amelyet ez az elem alkot: hidrogén – „vizet szül”, foszfor – „fényt hordoz”.
Az ókori görögök mítoszai: prométium - prométheusz, tantál - tantál
- földrajzi nevek
Földrajzi nevek: államok – gallium, germánium, polónium, ruténium; városok - lutécium (Párizs), hafnium (Koppenhága).
- csillagászati nevek
Csillagászat: szelén - hold, tellúr - föld, urán, neptunium
- tudósok nevei
Nagy tudósok nevei: fermium, curium, einsteinium, mendelevium
A kémiai elemek periódusos rendszerének felépítése, D. I. Mengyelejev
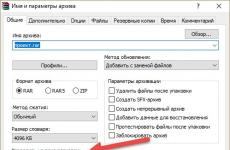
Most megnézzük a talán legfontosabb dokumentumot, egy „tipp” minden vegyész számára. Nyisd ki a tankönyved szárnyaslevelét, és használd az asztalodon lévő asztalokat is. Ön előtt a „Dmitrij Ivanovics Mengyelejev periódusos rendszere” táblázat. Amint látja, kissé eltérnek egymástól, de nem lényegesen. A periódusos rendszer a Kémiai Elemek Nagy Háza, amelyet 1869-ben D. I. Mengyelejev épített.
CSOPORTOK, amelyek mindegyike egy fő (elemek a bal oldalon) és egy másodlagos (elemek a jobb oldalon) alcsoportból áll Minden elemnek megvan a maga külön „lakása”, sorozatszámmal.Néhány „bejárat” csoportos , általános neveik vannak, amelyek tükrözik általános tulajdonságaikat: alkálifémek, halogének, nemes- vagy inert gázok .
Ezen kívül külön lent, az „alagsorban” vannak lantanidok és aktinidák, amelyek nagyon hasonlítanak a lantánra, mások pedig az aktiniumra.
A táblázat azt is tükrözi, hogy az elem egy adott csoporthoz tartozik: fém, nem fém vagy átmeneti elem.
GOU 1505. számú gimnázium „Moszkva Városi Pedagógiai Gimnázium-Laboratórium”
Absztrakt
A kémiai elemek periódusos rendszerének kémiai elemeinek nevének etimológiája D.I. Mengyelejev
Befejezve
8. tanuló "A" osztály
Gavrylyshyn Yura
Felügyelő:
Vody Zsoltye
Bevezetés……………………………………………………………………………………………………………… 3
§1. Helynévelemek…………………………………………………………………………. 5
§2. Kutatókról elnevezett elemek…………………………………………………………17
§3. Mitológiai hősökről elnevezett elemek………………………………21
4. §. Tulajdonságaikról elnevezett elemek…………………………………………………………….33
Következtetés…………………………………………………………………………………….45
Hivatkozások……………………………………………………………………………………………
BEVEZETÉS
Napjainkban a kémia tanításának számos különféle módszere létezik. A 9. osztályban a diákok ennek a tudománynak egy meglehetősen nagy és érdekes (bár egyáltalán nem egyszerű) részét tanulják - az elemek kémiáját. A tanárok másképp közelítik meg a tanítását - van, aki „memorizálásra” készteti az anyagot, van, aki gyakorlati órákat tart és kirándulásokra viszi a tanulókat, hogy jobban megértsék az anyagot, és van, aki ún. tantárgy integrálása valamilyen más tudománnyal: történelem, irodalom, nyelvészet stb., i.e. az egyik tudományt a másik prizmáján keresztül tanítja. Ezt a munkát kísérlet a kémia hasonló integrációjára a különböző bölcsészettudományokkal, különösen a nyelvészettel. Ez az egyik ága az ún. az egzakt tudományok humanitarizálása. Jelen esszé célja, hogy megpróbálja alternatív szemszögből megközelíteni a témát, elmélyíteni az elemek kémiájával kapcsolatos ismereteit, szélesíteni a látókörét, és választ találni a kémiai elemek nevének etimológiájával kapcsolatos különféle kérdésekre, mert nem sok figyelmet fordítanak erre a területre a modern iskolai kémia tankönyvekben. Tanulmányoztam bizonyos mennyiségű referenciairodalmat, elolvastam a kémiai elemek nevének etimológiájával kapcsolatos cikket, és több szótárat is felhasználtam a munka megírásához. Különböző tantárgyakból könyv kellett: kémia, történelem, nyelvészet, mitológia, mert... a különböző nevek eltérő megközelítést igényeltek - minden név különböző nyelvekből származott, és eltérő etimológiájúak voltak. Sok név mélyen a történelemben gyökerezik, így időnként ki kellett találnia, vagy kicsit saját maga után kell kutatnia. Ennek az absztraktnak a fő célja az volt, hogy a lehető legtöbb elemet lefedje a D.I. kémiai elemek periódusos rendszeréből. Mengyelejev, magyarázzon meg minél több nevet, és ossza fel az elemeket a nevük témájához kapcsolódó logikai csoportokba.
A munka megírása előtt a következő feladatokat tűztük ki magunk elé:
1) Osszuk az elemek összes nevét a nevük témájához kapcsolódó csoportokba (földrajz, mitológia, tudósok, az elemek tulajdonságai)
2) Keresse meg az egyes elemek nevének eredetét!
3) Az elvégzett munka alapján vonjon le következtetést!
4) Konkrét feladatok:
a) helyneveknél: rendezd időrendi sorrendbe az elemeket, keresd meg azokat a helyeket, amelyekről elnevezték őket
b) „mitológiai” elemeknél: keresse meg az elem nevének megfelelő karaktert, adjon meg egy mítoszt, amely ehhez vagy ahhoz a karakterhez kapcsolódik
c) tudósokról elnevezett elemek esetén: jelölje meg azt a tudóst, akiről az elemet elnevezték, adjon meg róla néhány információt
d) tulajdonságok szerint megnevezett elemeknél: keresse meg azt a jellemzőt, amely alapján ezt vagy azt az elemet elnevezték, utólag csoportosítva azokat a tulajdonság jellege szerint: szín, szag, méret, keménység, fajlagos tulajdonságok stb.
§1. Helynévelemek
- TOPONYM
a, m (különleges). Külön földrajzi hely (település, folyó, föld stb.) tulajdonneve.
Különböző okok miatt nevezték el az emberek az elemeket egy adott földrajzi helyről. Felfedezhető egy elem ezen a helyen (például dubnium - Dubna), vagy a tudós meg akarta örökíteni szülőföldjét a névben (polónium - Lengyelország), és néha volt ebben valami rejtett jelentés (például kalifornium, amelynek felfedezése Kalifornia megnyitásának nehézségei miatt azonosították). Az anyag kronológiai sorrendben történő bemutatása, hogy ne legyen ellentmondás az árammal földrajzi nevek- elvégre sok hely megváltoztatta a nevét, mióta ezt vagy azt az elemet felfedezték. Például lutécium. Hiszen lehetetlen kitalálni, hogy a Lutetia Párizs latin neve.
Réz (Cu)
A réz Cuprum (ókori Aes cuprium, Aes cyprium) latin neve Ciprus szigetének nevéből származik, ahol már a 3. században. I.E e. Voltak rézbányák, és rézolvasztást végeztek. Sztrabón (az ókori görög földrajztudós és történetíró a Kr. e. I. század közepén) az euboiai Chalkis város nevéből adódóan a rézt „kálkoknak” nevezte. Modern szóhasználattal a kalkos egy érc. Ebből a szóból származott számos ókori görög név a réz- és bronztárgyak, a kovácsmesterség, a kovácsmesterség és az öntvény számára. A réz második latin neve Aes (szanszkrit, ayas, gót aiz, németül erz, angol ore) ércet vagy enyémet jelent. Az európai nyelvek eredetére vonatkozó indogermán elmélet hívei az orosz réz (lengyel miedz, cseh med) szót az ónémet smida (fém) és Schmied (kovács, angol Smith) szavakból származtatják. Természetesen a gyökerek rokonsága ebben az esetben kétségtelenül azonban véleményünk szerint mindkét szó a görögből származik. az enyém, az enyém egymástól függetlenül. Ebből a szóból rokon nevek származtak - érem, medalion (francia medaille). A réz és a réz szavak a legősibb orosz irodalmi emlékekben találhatók. Az alkimisták a rezet Vénusznak nevezték; a régebbi időkben a Mars név megtalálható.
Stroncium (Sr)
A Stontian ásványban fedezték fel, amelyet 1764-ben találtak egy ólombányában a skót Stontian falu közelében. A kutatók sokáig bárium-karbonátnak tartották, de aztán I.E. Lovitz számos reakciót hajtott végre, és rájött, hogy ennek az elemnek semmi köze a báriumhoz. Az elektrolitikus fém stronciumot Davy szerezte 1808-ban. A 19. század eleji orosz kémiai irodalomban. megtalálhatók a stroncium (Gise, 1813), stroncium (Iovsky, 1822), stroncium (Strakhov, 1825), stroncium (Dvigubsky és Pavlov, 1825) nevek; emellett gyakran használták a „stronciánus föld alapja” elnevezést is.
berillium (Legyen)
Ennek az elemnek az oxidját először 1798-ban szerezte meg a francia kémikus, L.N. Vauquelin a Be 3 Al 2 Si 6 O 18 berill ásvány elemzésében. A smaragd és az akvamarin összetétele megegyezik (színüket különféle elemek szennyeződései adják) Az ásvány neve (görögül „beryllos”) a dél-indiai Belur (Velluru) város nevére nyúlik vissza, nem messze. Madras; Ősidők óta ismertek a smaragd lerakódások Indiában.
Magnézium és mangán (Mg, Mn)
Ezzel a két elemmel hosszúra sikeredett a történet. Az ókori görög filozófus, a milétusi Thalész egy vasat vonzó fekete ásvány mintáit tanulmányozta. „magnetis litosnak” nevezte – egy kő Magnéziából, egy hegyvidéki területről Thesszáliában, Észak-Görögország keleti részén. Ez egy híres terület volt. Jason ott építette az „Argo” hajót, Herkules barátja, Philoktétész pedig hajókat vitorlázott innen Trójába. A mágnes neve a Magnesia szóból származik. Ma már ismert, hogy mágneses vasérc volt - fekete vas-oxid Fe 3 O 4.
Mi köze ehhez a magnéziumnak és a mangánnak? Idősebb Plinius római természettudós használta ezt a kifejezést magnetis(vagy mágnesek) hasonló fekete ásvány megjelölésére, amely azonban nem rendelkezett mágneses tulajdonságokkal (Plinius ezt a kő „női nemével” magyarázta). Később ezt az ásványt piroluzitnak nevezték (a görög „pyr” szóból – tűz és „lusis” – tisztítás, mivel amikor az olvadt üveghez adták, elszíneződött). Mangán-dioxid volt. A középkorban a kéziratok másolásakor mágnesek először azzá változott mangán, majd be mangánok. 1774-ben Yu Gan egy új fémet izolált a piroluzitból, és ezt a nevet adta neki mangánok. Ebben a formában az európai nyelveken (angol és francia) rögzítették. mangán, német Mangan). Az orosz nyelv törvényei az „ngn” kombinációt „rgn”-re változtatták - így jelent meg a „mangán” a „mangánból”.
1695-ben az angliai Epsom Spring ásványvizéből sót izoláltak, amely keserű ízű és hashajtó hatású volt. A gyógyszerészek keserűnek, Epsom- vagy Epsom-sónak nevezték, az epsomit ásványi anyag összetétele MgSO 4 7H 2 O. A vegyészek pedig ennek a sónak a szódával vagy hamuzsírral készült oldataira ható fehér csapadékot kaptak - bázikus magnézium-karbonátot, amely eltérő lehet. összetétele, például 3MgCO 3 Mg(OH) 2 3H 2 O. Fehér magnézia volt ( magnézia alba), külsőleg porként, belsőleg pedig magas savtartalomra és enyhe hashajtóként használták (és használják most is). Bázikus magnézium-karbonát alkalmanként előfordul a természetben, és magnézia albaősidők óta ismert is. Ezt az ásványt valószínűleg Magnesia közelében találták, de valószínűleg egy másik. A tény az, hogy Magnesia lakói két azonos nevű várost alapítottak Kis-Ázsiában, ami zűrzavarhoz vezethet. E városok egyikét Manisa-nak hívják, és Törökország keleti csücskén található. A város környéke Niobe meséiről híres. Egy másik Magnézia délebbre volt, ahol a híres Artemisz-templom volt.
Lavoisier a fehér magnéziát egyszerű szilárd anyagnak tekintette. 1808-ban Humphry Davy angol kémikus enyhén megnedvesített fehér magnézia higanykatódos elektrolízisével új fém amalgámját (legfeljebb 3% magnéziumot tartalmaz), amelyet higany desztillálásával izolált és magnéziumnak nevezett. Azóta minden európai nyelven ezt az elemet hívják magnéziumés csak oroszul - magnézium: így hívta G.I. Hess 1831-ben megjelent kémia tankönyvében, amely hét kiadáson megy keresztül. Sok orosz kémikus tanult ebből a könyvből.
ruténium (Ru)
Ezt a platinacsoportba tartozó fémet K. K. Klaus fedezte fel Kazanyban 1844-ben, amikor az úgynevezett gyári platinalerakódásokat elemezte. Körülbelül 15 font ilyen maradékot kapott a szentpétervári pénzverdétől, miután az ércből kivonták a platinát és néhány platinafémet, Klaus a maradékot salétromsavval ötvözi, és a vízben oldódó részt (az ozmiumot, krómot és más fémeket tartalmazó) extrahálta. A vízben oldhatatlan maradékot aqua regia hatásának tette ki, és szárazra desztillálta. Miután a száraz maradékot forrásban lévő vízzel desztilláltuk és hamuzsírt adtunk hozzá, Klaus elválasztotta a vas-hidroxid csapadékot, amelyben a csapadék sósavas oldatának sötétlilás-vörös színe alapján egy ismeretlen elem jelenlétét fedezte fel. Klaus izolált egy új fémet szulfid formájában, és azt javasolta, hogy Oroszország tiszteletére ruténiumnak nevezzék el (latin Ruthenia - Oroszország). Ezt a nevet először 1828-ban Ozanne adta az általa vélt felfedezett elemek egyikének. Ozanne szerint a Nizhne Tagil platinaérc elemzésekor három platinafémet fedezett fel: a ruténiumot, a pluránt (az uráli platina szavak rövidítése) és a polint (görögül - szürke hajú, az oldat színe alapján). Berzelius, aki ellenőrizte Ozanne tesztjeit, nem erősítette meg felfedezését. Klaus azonban úgy gondolta, hogy Ozanne ruténium-oxidot szerzett, és ezt 1845-ös üzenetében is megemlítette. Zavidsky szerint a ruténiumot még korábban (1809-ben) fedezte fel Sznyadeckij vilnai tudós, aki az aszteroida nevében javasolta hírnek nevezni. Vesta, 1807-ben fedezték fel G.
gallium (Ga)
Megjósolta D.I. Mengyelejev mint eka-alumínium (mint az alumínium alcsoport eleme - ilyen jóslatok tehetők a periodikus törvény alapján), és 1875-ben fedezte fel Paul Émile Lecoq de Boisbaudran francia kémikus, aki hazájáról nevezte el ( Gallia- Franciaország latin neve). Franciaország szimbóluma a kakas (franciául - le coq), így az elem nevében felfedezője implicit módon a vezetéknevét örökítette meg.
lutécium (Lu)
A lutécium (angolul Lutecium, franciául Lutecium, németül Lutetium) felfedezése a földi itterbium tanulmányozásával függ össze. A felfedezés története összetett és hosszú. Mozander izolálta az erbiumföldet (erbiumot) az ittriumföldből, és 25 évvel később, 1878-ban Marignac kimutatta, hogy a gadolinitben az erbiummal együtt egy másik föld is található, amelyet itterbiumnak nevezett el. A következő évben Nilsson szkandiumot izolált az itterbium földből, amely a szkandium elemet tartalmazza. Aztán az itterbiummal kapcsolatos kutatásokat csak 1905-ben végezték, amikor is Urban, és valamivel később Auer von Welsbach arról számolt be, hogy a Marignac ytterbiumban van még két új terület, amelyek közül az egyik a lutéciumot, a másik a neoytterbium elemet tartalmazza.
Auer von Welsbach ugyanezeket az elemeket Cassiopeiumnak, illetve Aldebaraniumnak nevezte el. Évekig mindkét elnevezést használták a kémiai irodalomban. 1914-ben az Atomsúlyok Nemzetközi Bizottsága úgy döntött, hogy a 71-es elemet lutéciumnak és a 70-es elemet itterbiumnak nevezi el. Urban a lutetium szót a lutetiából, Párizs ősi latin nevéből (Lutetia Parisorum) származtatta.
ittrium, itterbium, terbium, erbium (Y, Yb, Tuberkulózis, Er)
1787-ben Karl Arrhenius amatőr ásványkutató új ásványt fedezett fel a Stockholm melletti Ruslagen szigetén, a svéd kisváros, Ytterby közelében lévő kőbányában, amelyet ytterbite-nek neveztek. Ezt követően számos új elemet fedeztek fel benne. Johan Gadolin finn kémikus 1794-ben fedezte fel az egyikük oxidját ebben az ásványban. A svéd Ekeberg 1797-ben ittriumföldnek nevezte el. ittria). Az ásványt később gadolinitnek nevezték el, a benne lévő elemet pedig ittriumnak nevezték el. 1843-ban Karl Mosander svéd vegyész kimutatta, hogy az "itriumföld" három oxid keveréke. Ahogy ezt a keveréket „felosztották” összetevőire, úgy a nevét is „felosztották”. Így jelent meg az itterbium, a terbium és az erbium. Mosander maga is képes volt tiszta formában izolálni az erbium- és terbium-oxidokat; A tiszta itterbium-oxidot 1878-ban a svájci kémikus, Jean Marignac izolálta, akit az a megtiszteltetés ért, hogy felfedezte ezt az elemet. Az ásvány története azonban ezzel nem ért véget...
germánium (Ge)
Mengyelejev 1871-ben előre látta a szilíciumhoz hasonló elem, az Eka-Silicium létezését. 15 évvel később, 1885-ben a welsbachi Freibergi Bányászati Akadémia ásványtan professzora a Freiberg melletti Himmelfürst bányában egy új ásványt fedezett fel, amelyet az ásványban lévő ezüst miatt argyroditnak nevezett el. Welsbach felkérte Winklert, hogy végezze el az ásványminta teljes elemzését. Winkler megállapította, hogy a teljes összeg alkatrészek Az ásványi anyag mennyisége nem haladja meg a vett minta 93-94%-át, ezért az ásványban valamilyen ismeretlen elem van jelen, amely elemzéssel nem mutatható ki. Kemény munka után 1886. február elején felfedezte az új elem sóit, és magának az elemnek egy részét tiszta formájában izolálta. A felfedezés első jelentésében Winkler azt javasolta, hogy az új elem az antimon és az arzén analógja. Ez az elképzelés irodalmi vitát váltott ki, amely nem csillapodott addig, amíg nem állapították meg, hogy az új elem az eca-szilícium, amelyet Mengyelejev jósolt. Winkler az elemet neptuniumnak szánta, ami azt jelenti, hogy felfedezésének története hasonló volt a Neptunusz bolygó felfedezésének Leverrier által megjósolt történetéhez. Kiderült azonban, hogy a Neptunium nevet már egy tévesen felfedezett elemnek adták, és Winkler hazája tiszteletére Germániumra nevezte át a felfedezett elemet. Ez a név éles ellenérzéseket váltott ki néhány tudósból. Például egyikük rámutatott, hogy ez a név hasonló egy virág nevéhez - muskátli (Geranium). A vita hevében Raymond tréfásan azt javasolta, hogy az új elemet Angulariumnak, azaz szögletesnek nevezzék, ami vitákat vált ki. Mengyelejev azonban Winklernek írt levelében határozottan támogatta a germánium nevet.
Holmium (Ho)
1879-ben a svájci kémikus és fizikus J.L. Soret egy új elemet fedezett fel az „erbiumföldben” spektrális elemzés segítségével. A nevet a svéd vegyész, P.T. Kleve Stockholm tiszteletére (ősi latin neve Holmia), mivel azt az ásványt, amelyből Kleve maga izolálta egy új elem oxidját 1879-ben, Svédország fővárosa közelében találták meg.
Túlium (Tm)
A tulium (túliumföld) felfedezése sok más elemhez hasonlóan arra az időre nyúlik vissza, amikor a ritkaföldfémek tanulmányozására szolgáló eszközök arzenálját a spektrális elemzés módszere gazdagította. A tulium felfedezésének háttere a következő. A 18. század végén. Ekeberg ittriumot izolált a gadolinitföldből, amelyet tiszta ittrium-oxidnak tekintettek, amíg Mozander három földre nem osztotta - ittriumra, terbiumra és erbiumra. 1878-ban Marignac két földet különített el Mozander terbiumföldjéből, erbiumot és itterbiumot. A földkeverékek tanulmányozása nem állt meg itt. A következő évben Cleve három földre osztotta fel Marignac erbiumát - erbiumra, holmiumra (ami keveréknek bizonyult) és tuliumba. Megkérte Nilssont (aki felfedezte a szkandiumot) a szkandium és itterbium extrakciójából származó maradék után, mert úgy gondolta, hogy ez a készítmény az erbiumsók viszonylag tiszta oldata. A gyógyszer több száz ismételt kicsapási és feloldási művelete után azonban az erbium még mindig tartalmazott valamilyen szennyeződést: az erbium atomtömege a különböző frakciókban nem volt azonos. Kleve Talenhez, az Uppsalai Egyetem fizikaprofesszorához fordult azzal a kéréssel, hogy vizsgálja meg ezen frakciók abszorpciós spektrumát, és hasonlítsa össze őket az erbium, az itterbium és az ittrium mintáinak spektrumával. Talen felfedezte az erbiumhoz és a holmiumhoz tartozó vonalakat az erbiumfrakcióban; a harmadik spektrum egy új elem jelenlétét jelezte. Így felfedezték a thúliumot, amelyet Kleve-nek neveztek el Skandinávia ősi (a Római Birodalom idejéből származó) nevének - Thule - tiszteletére. Kleve ezután 11 kg gadolinitot dolgozott fel, izolált tuliium-oxidot, és megvizsgálta halványzöld sóit. Tiszta tulium-oxidot azonban csak 1911-ben szereztek. Hogy mennyire nehéz volt meghatározni a tuliumot, és még inkább kémiailag izolálni tiszta oxidját, azt például a következő tények bizonyítják. A spektroszkópiai kutatások mestere, Lecoq de Boisbaudran úgy vélte, hogy két tulium létezik, a ritkaföldfémek legnagyobb kutatója, Auer von Welsbach pedig azt állította, hogy három tulium jelenlétét is megállapította.
Korábban a tulium szimbóluma Tu volt, és nem Tm, mint most. A múlt század végén és e század elején egyes kémiai munkákban a „thulium” szót gyakran tévesen írták.
Scandium (Sc)
1871-ben Mengyelejev az általa felfedezett periodikus törvény alapján számos elem létezését jósolta, köztük a bór analógját, amelyet eka - bórnak nevezett. Mengyelejev nemcsak magát az elemet jósolta meg, hanem az összes alapvető tulajdonságot is: atomi és fajsúly, kémiai tulajdonságok, oxid- és kloridképletek, sók tulajdonságai stb. Nyolc évvel később jóslata teljesen beigazolódott. Nilsson, az uppsalai analitikai kémia professzora az euxenit és a gadolinit ritkaföldfém ásványait tanulmányozta. Célja az volt, hogy a ritkaföldfémek vegyületeit tiszta formában izolálja az ásványoktól, meghatározza azok fizikai-kémiai állandóit, és tisztázza az elemek helyét a periódusos rendszerben. Nilsson 69 g erbiumföldet izolált más ritkaföldfémek keverékével euxenitből és gadolinitből. Ennek a mintának a felosztásával nagy mennyiségű itterbium-oxidot és ismeretlen földet kapott, amelyet összetévesztett egy ritkaföldfém elem oxidjával. De egy részletesebb tanulmány kimutatta, hogy ez valamiféle új elem. Nilsson skandiumnak nevezte el szülőföldje, Skandinávia tiszteletére. Az új elem Mengyelejev eca-bórjával való azonosságára egy másik uppsalai tudós, Kleve hívta fel a figyelmet, az oxidképletek hasonlóságára, a sók színtelenségére és az oxid lúgokban való oldhatatlanságára. Ezt követően az új elem helyet foglalt a periódusos rendszerben, amire Mengyelejev rámutatott. 1908 előtt azt hitték, hogy a szkandium rendkívül ritka a természetben. Crookes és Eberhard bizonyította ennek az elemnek a szétszórt állapotban való széles körű elterjedését. A fémes szkandiumot 1914-ben nyerték, és 1936-ban Fischer kifejlesztett egy módszert annak elektrolízissel történő izolálására alkálifém-klorid-olvadékból.
európium (Eu)
francia kémikus E.A. Demarsay 1886-ban izolálta az európiumot ritkaföldfémek keverékéből. Létét csak 15 évvel később spektrális elemzés igazolta, amikor Demarce 1901-ben az európai kontinens tiszteletére az Europium nevet adta az új elemnek.
polónium (Po)
1898-ban a csehországi, akár 75% uránt tartalmazó uránkátrány vizsgálatakor Curie-
Sklodowska észrevette, hogy a kátrány lényegesen nagyobb radioaktivitású, mint az ugyanabból a kátrányból izolált tiszta uránkészítmények. Ez arra utalt, hogy az ásvány egy vagy több új, nagy radioaktivitású elemet tartalmazott. Ugyanezen év júliusában Curie-Sklodowska elvégezte az uránkátrány teljes elemzését, gondosan figyelemmel kísérve a belőle izolált egyes termékek radioaktivitását. Az elemzés nagyon nehéznek bizonyult, mivel az ásvány több elemet is tartalmazott. Két frakció radioaktivitása megnövekedett; egyikük bizmutsókat, a másik bárium sókat tartalmazott. A bizmut frakcióból olyan terméket izoláltak, amelynek aktivitása 400-szor nagyobb volt, mint az uráné. Curie-Sklodowska arra a természetes következtetésre jutott, hogy az ilyen nagy aktivitás valamilyen eddig ismeretlen fém sóinak köszönhető. Polóniumnak nevezte el szülőföldje, Polonia (Lengyelország) tiszteletére. A felfedezés után néhány évig azonban a polónium létezését ellentmondásosnak tekintették. 1902-ben Markwald nagy mennyiségű (körülbelül 2 tonna) ásványon tesztelte az uránkátrány elemzését. Elkülönítette a bizmut frakciót, felfedezett benne egy „új” elemet, és radiotelluriumnak nevezte el, mivel a fém erősen radioaktív, más tulajdonságaiban is hasonló a tellúrhoz. Markwald megállapította, hogy az általa izolált radiotellúriumsó milliószor aktívabb volt az uránnál és 1000-szer aktívabb a polóniumnál. Az elem atomtömege 212, sűrűsége 9,3. Mengyelejev egy időben megjósolta egy ilyen tulajdonságú elem létezését, és a periódusos rendszerben elfoglalt várható helyzete alapján di-tellúriumnak nevezte el. Markwald megállapításait ráadásul több kutató is megerősítette. Rutherford azonban hamarosan megállapította, hogy a radiotellúrium az uránsorozat radioaktív bomlásának egyik terméke, és az elemet Ra-F-nek (Radium-F) nevezte el. Csak néhány évvel később vált nyilvánvalóvá, hogy a polónium, a radiotellúrium és a rádium-F ugyanaz az elem, alfa- és gamma-sugárzással és körülbelül 140 nap felezési idővel rendelkezik. Ennek eredményeként felismerték, hogy egy új elem felfedezésének elsőbbsége a lengyel tudósé, és az általa javasolt nevet megtartották.
Hafnium (Hf)
A vegyészek sokáig azt gyanították, hogy a cirkónium ásványok valamilyen ismeretlen elem keverékét tartalmazzák. Svanberg svéd kémikus még 1845-ben beszámolt egy elem felfedezéséről a cirkonban, amelyet noriumnak nevezett. Ezt követően sok kutató beszámolt ennek az elemnek a felfedezéséről, de ez minden alkalommal hiba volt. 1895-ben Thomsen a periodikus törvény alapján kimutatta, hogy a ritkaföldfémek és a tantál között a ritkaföldfémektől eltérő, de a cirkóniumhoz közeli elemnek kell lennie. 1911-ben Urban, miközben elválasztotta az ittriumföldet a gadolinittől, felfedezte, hogy egy frakció több ismeretlen spektrumvonalat hoz létre. Arra a következtetésre jutott, hogy létezik egy új elem, amely a ritkaföldfémek csoportjába tartozik, és Celtiumnak nevezte el. Miután Mosely felfedezte az elemek röntgenspektrumát és sorszámukat (1913-1914), kiderült, hogy az új elemnek a 72-es rendszámúnak kell lennie. Mosely azonban nem találta ennek az elemnek a vonalait Urbain celiumában. . Feltételezve, hogy a röntgenspektrumok meghatározásának tökéletlen technológiája volt a hibás, Urban felkérte Deauvillier fizikust, hogy ismételje meg a kísérletet. Deauvillier két, a 72-es elemre jellemző gyenge vonalat tudott felfedezni, ezért az elem a celium nevet kapta. De a következő évben Koster és Hevesy megtalálta ezeket a sorokat és több hasonlót is különböző cirkonokban. Ez bizonyítékul szolgált arra, hogy a 72-es elem nem tartozik a ritkaföldfémek közé, hanem a cirkónium analógja. A Hevesy által nem sokkal ezután izolált 72-es elemet mindkét kutató dán lévén úgy döntött, hogy Koppenhága város ősi nevéből (Hafnia vagy Kjobn-hafn) hafniumnak (Hafnium) nevezi el, mivel felfedezésük ebben a városban történt. .
Rénium (Re)
Ida és Walter Noddack német kémikusok fedezték fel 1925-ben, és a Rajna tartományról – Ida szülőföldjéről – nevezték el.
Francium (Fr)
A francium Mengyelejev periódusos rendszerének azon négy eleme egyike, amelyeket „ben fedeztek fel utolsó lehetőség" 1925-re ugyanis az elemtáblázat összes cellája kitöltésre került, a 43, 61, 85 és 87 kivételével. A hiányzó elemek feltárására tett számos kísérlet hosszú ideig sikertelen maradt. A 87-es elemet (eka-cézium (vagyis a céziumhoz hasonló tulajdonságú elem; hasonló jóslatok születnek Mengyelejev periódusos törvénye és az elemek periódusos rendszere alapján) főként cézium ásványokban keresték, abban a reményben, hogy a cézium műholdjaként megtalálják. cézium 1929-ben Mr. Allison és Murphy beszámolt az ecézium felfedezéséről az Egyesült Államok államának – Allison szülőföldjének – tiszteletére, és elnevezte a 87-es elemet A szerzők az ec-cézium 87 felfedezéséről is tudósítottak, és a névgyűjteményt lúggal és russziummal gazdagították, azonban 1939-ben Perey a párizsi Curie Intézettől a tisztítással foglalkozott Különböző radioaktív bomlástermékekből származó aktínium készítményről Gondosan ellenőrzött műveleteket végezve fedezte fel a béta-sugárzást, amely nem tartozhatott az akkor ismert aktínium-sorozat egyik bomlási izotópjához sem... A második világháború után. megszakította Perey munkáját, következtetései teljes mértékben beigazolódtak. 1946-ban Perey azt javasolta, hogy hazája tiszteletére a 87-es elemet franciumnak nevezzék el.
Americium (Am)
Glenn Seaborg és munkatársai mesterségesen szerezték be 1944-ben a Chicagói Egyetem Kohászati Laboratóriumában. Az új elem (5f) külső elektronhéja az európiumhoz (4f) hasonlított. Ezért az elemet Amerikáról nevezték el, ahogy az európiumot is Európáról.
Berkeley (Bk)
1949 decemberében nyitották meg Thompson, Ghiorso és Seaborg a Berkeley-i Kaliforniai Egyetemen. Ha az americium-241 izotópot alfa-részecskékkel (2 protonból és 2 neutronból, egy hélium-4 atom magjából (4 He 2+) alkotott pozitív töltésű részecskék) sugározzuk be. megkapták a 243 Vk berkelium izotópot. Mivel a Bk szerkezeti hasonlóságot mutat a terbiummal, amely nevét a svédországi Ytterby városáról kapta, az amerikai tudósok Berkeley városáról nevezték el elemüket. A berkelium név gyakran megtalálható az orosz irodalomban.
Kalifornia (Vö)
Ugyanez a csoport mesterségesen szerezte be 1950-ben. Mint a szerzők írták, ezzel a névvel azt akarták jelezni, hogy számukra ugyanolyan nehéz volt felfedezni egy új elemet, mint egy évszázaddal ezelőtt az amerikai úttörőknek Kaliforniába eljutni, mert... igen csekély mennyiségű (körülbelül 5000 atom) vizsgált anyagon ismerték fel. Ezenkívül figyelembe veszik a kalifornium és a ritkaföldfém elem, a diszprózium tulajdonságai közötti megfelelést. A felfedezés szerzői arról számoltak be, hogy „a diszprózium nevét egy görög szó alapján nevezték el, ami azt jelenti, hogy nehéz megszerezni; egy másik (megfelelő) elem felfedezése egy évszázaddal később szintén nehéznek bizonyult Kaliforniában.”
Azok. 1) 5000 részecske: 6,02 × 10 23 (Avogadro-szám - egy mól anyagban lévő részecskék száma) = 8,3 × 10 -21 mol
2) 8,3 × 10 -21 × 251 g\mol (Kalifornia moláris tömege) = 2,083 × 10 -18 gramm
Dubnium (Db)
A 105-ös elemet először a dubnai gyorsítónál szerezték be 1970-ben a G.N. Flerov és önállóan Berkeleyben (USA). A szovjet kutatók azt javasolták, hogy nevezzék el nilsbóriumnak (Ns), Niels Bohr tiszteletére az amerikaiak - ganium (Ha), Otto Hahn tiszteletére, az urán spontán hasadásának felfedezésének egyik szerzője, az IUPAC bizottság - joliotium (Jl) ), Joliot Curie tiszteletére, vagy, hogy senki ne sértődjön meg, a szanszkrit szám unnilpentium (Unp), vagyis egyszerűen a 105. A különböző években megjelent elemtáblázatokban az Ns, Na, Jl szimbólumok láthatók. Ezt az elemet most dubniumnak hívják. A város és sajátosságai tükröződnek az irodalomban - Galich „És nem a Dubna atomban él, hanem valami Kashira melletti kutatóintézetben…” című verseiben.
Hassiy (Hs)
A 108-as elemről az első megbízható adatokat 1984-ben szerezték meg Dubnában, és függetlenül és egyidejűleg egy Darmstadt melletti gyorsítónál - egy Hessen szövetségi államban található város, ennek az ősi német fejedelemségnek, majd a Hesse-Darmstadt nagyhercegségnek a latin neve. - Hassia, innen ered az elem neve (bár oroszul logikusabb lenne hessiumnak nevezni). És zavart okoztak a nevek ezzel az elemmel (korábban ganiumnak hívták).
§2. Kutatókról elnevezett elemek
A modern kémia tankönyvekben kevés figyelmet szentelnek a tudósoknak, és közvetlenül csak felfedezéseiket és eredményeiket tanulmányozzák. Ennek a fejezetnek az a célja, hogy bővítse a tudósokról és kiemelkedő kutatókról szóló ismereteket, így vagy úgy, hogy részt vesznek az elemek felfedezésében, tanulmányozásában és elnevezésében.
Egyes vélemények szerint a fiatal kutatók (40 év alattiak) nagyobb valószínűséggel örökítik meg nevüket felfedezéseik címében. Úgy döntöttünk, hogy megnézzük, és rájöttünk, hogy valóban létezett és talán még mindig létezik ilyen tendencia!
Gadolínium (Gd)
1794-ben Gadolin, az Abo Egyetem (Finnország) kémia és ásványtan professzora, miközben a Stockholmtól három mérföldre fekvő Ytterby város közelében talált ásványt tanulmányozott, ismeretlen földet (oxidot) fedezett fel benne. Néhány évvel később Ekeberg újra megvizsgálta ezt a földet, és miután megállapította a berillium jelenlétét, ittriumnak (Yttria) nevezte el. Mazander megmutatta, hogy az ittrium föld két földből áll, amelyeket terbiumnak és erbiumnak nevezett el. Ezenkívül Marignac a szamarszkit ásványból izolált terbiumföldben egy másik földet fedezett fel - a szamáriumot (Samaria). 1879-ben Lecoq de Boisbaudran izolálta ugyanazt a földet a didímiumtól és az általa „alfa” indexszel jelölt új földtől, és Marignac beleegyezésével az utóbbit Gadolin, az ásvány első kutatója tiszteletére gadolíniumföldnek nevezte el. ytterbite. A gadolínium földben (Gadolinia) található elemet gadolíniumnak nevezik; tiszta formájában 1896-ban szerezték be.
Szamárium (Sm)
A szamárium felfedezése a Mozander által a cériumföldből izolált didímiumföld kitartó kémiai-analitikai és spektrális vizsgálatainak eredménye. Több évtizedig azután, hogy Mozander izolálta a didímiumot a lantanaföldből, a didímium elem létezését feltételezték, bár egyes vegyészek azt gyanították, hogy több elem keveréke. század közepén. a didímiumföld beszerzésének új forrása a szamarszkit ásvány volt, amelyet V. M. Szamarszkij orosz bányamérnök fedezett fel az Ilmen-hegységben; Később a samarskitet Észak-Amerikában, Észak-Karolina államban találták meg. Sok vegyész elemezte a samarskitet. 1878-ban Delafontaine, aki a szamarszkitból izolált didim mintákat vizsgálta, két új kék vonalat fedezett fel a spektrumban. Úgy döntött, hogy ezek egy új elemhez tartoznak, és ennek értelmes nevet adta a decipere (latin decipere - bolondozni, megtéveszteni). Más jelentések is érkeztek új vonalak felfedezéséről a didima spektrumában. Ezt a problémát 1879-ben oldották meg, amikor Lecoq de Boisbaudran a didímium szétválasztására törekedve azt találta, hogy az egyik frakció spektroszkópiai elemzése két kék vonalat ad, amelyek hullámhossza 400 és 417 A. Arra a következtetésre jutott, hogy ezek a vonalak különböznek a Decipium Delafontaine sorait, és azt javasolta, hogy az új elemet szamáriumnak nevezzék, hangsúlyozva, hogy a szamarszkittól izolálták. A Decipiusról kiderült, hogy a szamárium és a didimía egyéb elemeinek keveréke. Lecoq de Boisbaudran felfedezését 1880-ban Marignac erősítette meg, akinek a samarskite elemzése során sikerült két új elemeket tartalmazó frakciót nyernie. A Marignac az Y béta és Y alfa frakciókat jelölte meg. Később az Y alfa frakcióban lévő elemet gadolíniumnak nevezték el, míg az Y béta frakció spektruma hasonló volt a Lecoq de Boisbaudran-féle szamáriuméhoz. 1900-ban Demarsay, aki a frakcionált kristályosítás új módszerét dolgozta ki, megállapította, hogy az európium elem a szamárium szatellitja.
Fermium és einsteinium (Fm), (Es)
1953-ban az amerikaiak által 1952-ben végrehajtott termonukleáris robbanás termékeiben két új elem izotópjait fedezték fel, amelyeket fermiumnak és einsteiniumnak neveztek el - Enrico Fermi és Albert Einstein fizikusok tiszteletére.
Kúrium (cm)
Az elemet 1944-ben Glenn Seaborg vezette amerikai fizikusok egy csoportja szerezte meg plutónium héliummagokkal történő bombázásával. Nevét Pierre és Marie Curie után kapta. Az elemek táblázatában a kúrium közvetlenül a gadolínium alatt található - így amikor a tudósok kitalálták az új elem nevét, valószínűleg arra is gondoltak, hogy a gadolínium volt az első elem, amelyet a tudósról neveztek el. Az elemszimbólumban (Cm) az első betű a Curie vezetéknevet, a második betű a Marie keresztnevet jelenti.
Mendelevium (Md)
Először 1955-ben jelentette be Seaborg csoportja, de csak 1958-ban sikerült megbízható adatokat szerezni Berkeley-ben. D. I. tiszteletére nevezték el. Mengyelejev.
Nobelium (nem)
Felfedezéséről először 1957-ben számolt be egy Stockholmban dolgozó nemzetközi tudóscsoport, akik azt javasolták, hogy az elemet Alfred Nobel tiszteletére nevezzék el. Később kiderült, hogy a kapott eredmények hibásak. Az első megbízható adatokat a 102-es elemről a Szovjetunióban szerezte meg a G.N. Flerov 1966-ban. A tudósok azt javasolták, hogy az elemet Frederic Joliot-Curie francia fizikus tiszteletére nevezzék át, és joliotiumnak (Jl) nevezzék el. Kompromisszumként javaslat született az elem Flerovium elnevezésére - Flerov tiszteletére. A kérdés nyitva maradt, és több évtizeden át zárójelbe került a Nobelium szimbólum. Így volt ez például a Chemical Encyclopedia 1992-ben megjelent 3. kötetében, amely a Nobeliumról szóló cikket tartalmazott. Idővel azonban a probléma megoldódott, és ennek az enciklopédiának a 4. kötetétől (1995), valamint más kiadványokban a Nobelium szimbólum zárójelből szabadult fel. Általánosságban elmondható, hogy a transzurán elemek felfedezésének elsőbbségi kérdése hosszú évek óta heves vita tárgya. A 102-től 109-ig terjedő elemneveknél a végső döntés 1997. augusztus 30-án született. E döntésnek megfelelően itt adjuk meg a szupernehéz elemek nevét.
Lawrence (Lr)
A 103-as elem különféle izotópjainak előállítását 1961-ben és 1971-ben (Berkeley), 1965-ben, 1967-ben és 1970-ben (Dubna) számolták be. Az elem nevét Ernest Orlando Lawrence amerikai fizikusról és a ciklotron feltalálójáról kapta. A Berkeley Nemzeti Laboratórium Lawrence nevéhez fűződik. A periódusos táblázatainkban sok éven át zárójelben szerepelt az Lr szimbólum.
Rutherfordium (Rf)
Az első kísérleteket a 104-es elem előállítására a Szovjetunióban Ivo Zvara és munkatársai végezték még a 60-as években. G.N. Flerov és munkatársai arról számoltak be, hogy megszerezték ennek az elemnek egy másik izotópját. Javasolták, hogy nevezzék el kurchatoviumnak (Ku szimbólum) - a Szovjetunió atomprojektjének vezetőjének tiszteletére. I.V. Kurcsatova. Amerikai kutatók, akik 1969-ben szintetizálták ezt az elemet, használták új technika azonosítása, hisz a korábban kapott eredmények nem tekinthetők megbízhatónak. Ők javasolták a rutherfordium nevet – Ernest Rutherford kiváló angol fizikus tiszteletére az IUPAC a dubnium nevet javasolta ennek az elemnek. A nemzetközi bizottság arra a következtetésre jutott, hogy a megnyitó megtiszteltetésén mindkét csoport osztoznia kell.
Seaborgium (Sg)
A 106-os elemet a Szovjetunióban szerezték be. G.N. Flerov és munkatársai 1974-ben és szinte egyidejűleg az USA-ban. G. Seaborg és munkatársai. 1997-ben az IUPAC jóváhagyta ennek az elemnek a seaborgium elnevezést, az amerikai nukleáris kutatók pátriárkája, Seaborg tiszteletére, aki részt vett a plutónium, americium, curium, berkelium, kalifornium, einsteinium, fermium, mendelevium felfedezésében, és aki addigra 85 éves volt. Van egy jól ismert fénykép, amelyen Seaborg az elemek táblázata közelében áll, és mosolyogva mutat Sg szimbólumra.

Bórium (Bh)
Első megbízható információkat A 107-es elem tulajdonságairól az 1980-as években Németországban szerezték be. Az elem neve Niels Bohr ( Bohr). Szimbólum Bh.
Niels Bohr (1885-1962) - dán fizikus, a modern fizika egyik alapítója. a koppenhágai Elméleti Fizikai Intézet (Niels Bohr Intézet) alapítója és igazgatója; a világ teremtője tudományos iskola; a Szovjetunió Tudományos Akadémia külföldi tagja (1929). 1943-45-ben az USA-ban dolgozott.
Niels Bohr megalkotta az atom elméletét, amely az atom bolygómodelljén, a kvantumfogalmakon és a Bohr által javasolt posztulátumokon alapult. Fontos munkák a fémek elméletéről, az atommag elméletéről és a magreakciókról. A természettudomány filozófiájával foglalkozik. Az atomfenyegetés elleni küzdelem aktív résztvevője. 1922-ben Nobel-díjat kapott.
§3. Mitológiai hősökről elnevezett elemek
Feltételeztük, hogy az elemek mitológiai nevei alternatívát jelentenek az elem tulajdonságaihoz kapcsolódó nevek helyett. Ez egy szokatlan nézet egy adott vegyület tulajdonságairól. Úgy döntöttünk, hogy ebbe a fejezetbe a nevek általános értelmezése mellett belefoglalunk egy mítoszt is, amely ahhoz a karakterhez kapcsolódik, akiről az elemet elnevezték. Mindez segít bővíteni a mitológiai ismereteit, valamint rendhagyó pillantást vetni az elemekre és tulajdonságaikra.
Kadmium (Cd)
Friedrich Strohmeyer német vegyész és gyógyszerész fedezte fel 1818-ban cink-karbonátban, amelyből a gyógyszereket egy gyógyszergyárban szerezték be. Ősidők óta a görög „kadmeia” szót használják a karbonátos cinkércek leírására. A név a mitikus Kadmuszra (Kadmos) - a görög mitológia hősére - nyúlik vissza. Állítólag Kadmus volt az első, aki megtalálta a cink ásványt, és felfedezte az emberek számára, hogy képes megváltoztatni a réz színét az érceik (réz és cink ötvözete – sárgaréz) együttes olvasztása során. A Kadmusz név a sémi „Ka-dem” – keletre – nyúlik vissza.
A görög mitológiában Kadmusz Agenor, Kánaán királya és Telephassa, Théba alapítójának fia (Boiotiában). Apja más testvéreivel együtt Európát keresni küldte, Kadmosz anyja, Telephassa kíséretében Rodoszra hajózott, ahol bronz üstöt szentelt Athénének, és felépítette Poszeidón templomát, örökös papokra bízva annak gondozását. Aztán megérkeztek Thera szigetére, ahol templomot is építettek, majd eljutottak Trákiába, és a helyi lakosság szeretettel fogadta őket. Itt Telephassa váratlanul meghalt, és a temetés után Kadmusz és társai gyalog mentek Delphibe. Ott Apolló jósdájához fordult, és azt az utasítást kapta, hogy hagyja abba a keresést, és kövessen egy tehenet, amelynek oldalán holdjelek láthatók; ahol a tehén összeesik a fáradtságtól, Cadmusnak várost kell találnia. A szentélyből kilépve Kadmusz találkozott pásztorokkal, akik Pelagont, Phokis királyát szolgálták, és eladtak neki egy tehenet, amelyen a telihold jelei voltak az oldalán. Kelet felé terelte az állatot egész Boiotián, nem engedte, hogy sehol pihenjen, amíg a kimerült tehén le nem esik. Hogy feláldozzon egy tehenet Athénének, Kadmus társakat küldött Ares forrásához, hogy megtisztítsák a vizet, nem tudván, hogy a forrást egy sárkány őrzi. Ez a sárkány elpusztította Cadmus legtöbb társát, amiért Kadmus kővel hasította a fejét. Mielőtt még ideje lett volna, hogy áldozatot hozzon Athénének, ő maga megjelent, és megdicsérte mindazért, amit tett, miközben elrendelte, hogy az általa megölt kígyó fogainak felét vesse el (Athéné a fogak második felét a kolchi királynak adta Eetus, aki aztán Jasonnak adta). Amikor Kadmus mindent megtett, felfegyverzett emberek (Sparti, vagy „bevetett emberek”) kiugrottak a földből, és zörögni kezdték a fegyvereiket. Követ dobott a soraik közé, ami veszekedést váltott ki: mindegyik vádolni kezdte a másikat, hogy ő dobta a követ. Olyan hevesen harcoltak, hogy végül csak öten maradtak életben: Echion, Udeus, Chthonius, Hyperenor és Pelor. Mindannyian egyöntetűen kijelentették, hogy készek Kadmus szolgálatára, és ezt követően a legelőkelőbb thébai családok ősei lettek a Kadmus által alapított Kadmeusz erődben, amely körül Théba nőtt. Mivel a megölt sárkány Arész fia volt, a háború istene megtorlást követelt, és Kadmusznak nyolc évig a rabszolgájaként kellett szolgálnia. Ennek a szolgálatnak a befejezése után Athéné Kadmea (később Théba) királyává tette Kadmust, Zeusz pedig Harmóniát, Arész és Aphrodité lányát adta feleségül. Ez volt az első halandó esküvő, amelyen az olimpiai istenek részt vettek. Harmónia világra hozta Kadmusz fiát, Polydorust, akinek Laius unokája volt, és négy lányát: Autonoiát, Inót, Agavét és Személét. Idős korában Kadmusz Harmóniával együtt Illíriába költözött, ahol kígyókká változtak, és végül Elysiumban (az áldottak földjén, ahová a hősök és az igazak a halál után) kötöttek ki. Kadmus nevéhez fűződik a görög írás feltalálása (egy másik változat szerint a föníciai ábécé bevezetése Görögországban).
Kobalt (Co)
A 15. században Szászországban gazdag ezüstércek között acélszerűen fénylő fehér vagy szürke kristályokat fedeztek fel, amelyekből nem lehetett kiolvasztani a fémet; ezüsttel vagy rézérccsel való keveredésük megzavarta ezen fémek olvasztását. A „rossz” ércnek a Kobold hegyszellem nevet adták a bányászok. Nyilvánvalóan ezek arzéntartalmú kobalt ásványok - kobaltin CoAsS, vagy kobalt-szulfidok skutterudit, szaflorit vagy szmaltit. Kiégetésükkor illékony, mérgező arzén-oxid szabadul fel. Valószínűleg a gonosz szellem neve a görög „kobalos” - füstre nyúlik vissza; arzén-szulfidokat tartalmazó ércek pörkölése során keletkezik. A görögök ugyanezt a szót használták a hazug emberek leírására. 1735-ben Georg Brand svéd ásványkutatónak sikerült egy eddig ismeretlen fémet izolálnia ebből az ásványból, amelyet kobaltnak nevezett el. Azt is kiderítette, hogy ennek az elemnek a vegyületei üvegkék színűek - ezt a tulajdonságot az ókori Asszíriában és Babilonban használták.
Kobold - Észak-Európa mitológiájában a bánya szelleme volt. A megjelenés leírása hasonló a gnómokhoz, azonban a gnómokkal ellentétben a koboldok nem foglalkoztak bányászmesterséggel, hanem csak a bányákban éltek. Néha kopogtatóknak nevezik őket, mert úgy tartják, hogy ők kopogtatják a lábukat, miközben az alagutakban futnak.
A koboldok általában bányászként öltözködnek, és tűzvörös (néha szó szerint izzó) szakálluk van. Mindig vigyen magával lámpát. Segíthetnek egy eltévedt bányásznak kijutni, vagy éppen ellenkezőleg, a legsötétebb elhagyatott területbe vezethetik. Maguk soha nem hagyják el a bányát, de tudnak kommunikálni a patkányokkal, és néha a felszínre küldhetik őket.
Félnek a naptól, és mint a legtöbben földalatti lakosok, első sugarával kővé változik.

Nikkel (Ni)
A név eredete hasonló a kobalthoz. A középkori bányászok a nikkelt a gonosz hegyi szellemnek nevezték, aki hamis ásványokat dobott a bányászoknak, és „kupfernickelnek” ( Kupfernickel, réz ördög) - hamis réz. Ez az érc megjelenésében hasonlított a rézhez, és az üveggyártásban használták az üveg zöld színezésére. De senkinek sem sikerült rezet szereznie belőle - nem volt ott. Ezt a rézvörös nikkelkristályt (vörös nikkelpirit NiAs) Axel Kronstedt svéd ásványkutató tanulmányozta 1751-ben, és egy új fémet izolált belőle, nikkelnek nevezve a bányászok nyelvén. Egy eltorzított Nicolausból alakult, egy általános szóból, amelynek több jelentése is volt. De főleg a Nicolaus szó szolgált a kétarcú emberek jellemzésére; ezen kívül „huncut kis szellemet”, „megtévesztő lustaságot” stb. jelentett. A 19. század eleji orosz irodalomban. a Nikolan (Scherer, 1808), Nikolan (Zakharov, 1810), a nikol és a nikkel (Dvigubsky, 1824) neveket használták.
Nióbium és tantál (Nb), (Ta)
Charles Hatchet angol kémikus 1801-ben elemzett egy fekete ásványt, amelyet a British Museumban tároltak, és 1635-ben találtak az USA modern Massachusetts területén. Hatchet egy ismeretlen elem oxidját fedezte fel az ásványban, amelyet Columbiának neveztek el - annak az országnak a tiszteletére, ahol megtalálták (akkoriban az Egyesült Államoknak még nem volt ismert neve, és sokan Columbiának nevezték el a felfedező után a kontinens). Az ásványt kolumbitnak nevezték. 1802-ben Anders Ekeberg svéd kémikus egy másik oxidot izolált a kolumbitból, amely makacsul nem volt hajlandó feloldódni (ahogy akkor mondták, telítődni) semmilyen savban. Az akkori kémia „törvényhozója”, Jene Jakob Berzelius svéd kémikus javasolta, hogy az ebben az oxidban található fémet tantálnak nevezzék el. Tantalus az ókori görög mítoszok hőse; Jogellenes cselekménye miatt büntetésül nyakig beállt a vízbe, amely felé termős ágak dőltek, de sem berúgni, sem betelni nem tudott. Hasonlóképpen, a tantál nem tudott „eleget kapni” a savból – visszahúzódott belőle, mint a tantálból származó víz. Ennek az elemnek a tulajdonságai annyira hasonlóak voltak a kolumbiummal, hogy sokáig vita folyt arról, vajon a kolumbium és a tantál azonos vagy különböző elemek-e. A német kémikus, Heinrich Rose csak 1845-ben oldotta meg a vitát több ásvány, köztük a bajorországi kolumbit elemzésével. Megállapította, hogy valójában két hasonló tulajdonságú elem létezik. A Hatchet-féle Columbia ezek keverékének bizonyult, és a kolumbit (pontosabban manganokolumbit) képlete (Fe,Mn)(Nb,Ta) 2 O 6 . Rose a második elemet nióbiumnak nevezte el, Tantalus lánya, Niobe után. A Cb szimbólum azonban a 20. század közepéig megmaradt az amerikai kémiai elemek táblázataiban: ott a nióbium helyén állt. Hatchet neve pedig a Hatchite ásvány nevében van megörökítve.
A következő mítosz Niobéhez kapcsolódik.
Mindkét szó (Thor isten és "mennydörgés") a kelta nyelvhez kapcsolódik taranis(Ír) tarann) - mennydörgésés isten Taranis .
Titán (Ti)
Úgy gondolják, hogy ezt az elemet Martin Klaproth német kémikus fedezte fel. 1795-ben egy ismeretlen fém oxidját fedezte fel az ásványi rutilban, amelyet titánnak nevezett el. A titánok óriások, akikkel az olimpiai istenek harcoltak. Két évvel később kiderült, hogy a „menakin” elem, amelyet William Gregor angol kémikus fedezett fel 1791-ben az ilmenit ásványban (FeTiO 3), azonos Klaproth titánjával.
1846-ban a csillagászok egy új bolygót fedeztek fel, amelyet nem sokkal korábban Le Verrier francia csillagász jósolt meg. Neptunusznak nevezték el - a víz alatti királyság ókori görög istene után. Amikor 1850-ben egy új fémnek hitt fémet fedeztek fel egy, az Egyesült Államokból Európába szállított ásványban, a csillagászok azt javasolták, hogy ezt neptuniumnak kell nevezni. Hamar kiderült azonban, hogy a nióbiumról van szó, amelyet már korábban felfedeztek. A „neptúnium” majdnem egy évszázadra feledésbe merült, mígnem új elemet fedeztek fel az urán neutronos besugárzásának termékeiben. És ahogy a Naprendszerben az Uránt a Neptunusz követi, úgy az elemek táblázatában a Neptunium (93. sz.) az urán (92. sz.) után jelent meg.
A római mitológiában Neptunusz a tengerek és a patakok istene, akit a görög Poszeidónnal azonosítanak. Neptun felesége Salacia volt, akit Thetisszel és Amphitrittel azonosítottak. A szörfhullámokat megszemélyesítő Vinilia nimfa a tengeristen köréhez tartozott.
1930-ban fedezték fel a Naprendszer kilencedik bolygóját, amelyet Lovell amerikai csillagász jósolt meg. Plútónak nevezték el – az alvilág ókori görög istene után. Ezért logikus volt, hogy a következő elemet a neptúnium-plutóniumról nevezzük el; 1940-ben nyerték az urán deutériummagokkal - nehéz hidrogén (hidrogén-3 izotóp) történő bombázása eredményeként.
A görög mitológiában a Plútó a holtak birodalma uralkodójának, Hádésznek az egyik neve, jelentése „gazdag”.
4. §. Tulajdonságaikról vagy vegyületeik tulajdonságairól elnevezett elemek
Ha megérti, hogy egy elem milyen tulajdonságához kapcsolódik a neve, hogyan fordítják, mit jelent, akkor jobban megértheti az elemek kémiájának anyagát, megérteniés megtanulják az egyes anyagok vagy elemek tulajdonságait.
Fluor (F)
Ennek az elemnek sokáig csak származékait ismerték, köztük a rendkívül maró hidrogén-fluoridot, amely még az üveget is feloldja, és nagyon súlyos, nehezen gyógyuló égési sérüléseket hagy a bőrön. Ennek a savnak a természetét 1810-ben A.M. francia fizikus és vegyész állapította meg. Amper; nevet javasolt a megfelelő elemnek (melyet jóval később, 1886-ban izoláltak): a görögből. „fluoros” - pusztulás, halál.
Klór (Cl)
Görögül a „chloros” jelentése sárgászöld. Ez a gáz színe. Ugyanez a gyök található a „klorofill” szóban (a görög „chloros” és „phyllon” levélből). Kezdetben az elemet rágcsálónak (muria - sóoldat, sós víz) nevezték el leggyakoribb vegyülete - nátrium-klorid vagy konyhasó - neve után. De aztán Davy, a tudós, aki először izolálta a klórt, úgy döntött, hogy átnevezi az elemet a Párizsi Tudományos Akadémia nómenklatúrájának rendelkezései alapján, ahol előnyösebb volt az elemeket tulajdonságaik alapján nevezni.
Bróm (Br)
Görögül "bromos" azt jelenti, hogy rossz. A bróm fullasztó szaga hasonlít a klór szagához.
ozmium (Os)
Görögül az "osme" szaglást jelent. Bár maga a fém nem szaga, az erősen illékony ozmium-tetroxid OsO 4 meglehetősen kellemetlen szagú, hasonlóan a klór és a fokhagyma szagához.
jód (I)
Görögül a "jód" jelentése lila. Ez az elem gőzeinek színe, valamint nem szolvatáló oldószerekben (alkánok, szén-tetraklorid stb.) készült oldatai.
Króm (Cr)
A „chroma” görögül színt, színt jelent. Sok krómvegyület élénk színű: az oxidok zöldek, feketék és vörösek, a hidratált Cr(III)-sók zöldek és lilák, a kromátok és a dikromátok pedig sárgák és narancssárgák.
Irídium (Ir)
Az elem elnevezése lényegében ugyanaz, mint a króm; görögül „iris” („iridos”) - szivárvány, Iris - a szivárvány istennője, az istenek hírnöke. Valójában a kristályos IrCl rézvörös, az IrCl 2 sötétzöld, az IrCl 3 olívazöld, az IrCl 4 barna, az IrF 6 sárga, az IrS, az Ir 2 O 3 és az IrBr 4 kék, az IrO 2 pedig a fekete. Az „iridizáció” szó azonos eredetű - egyes ásványok felületének irizáló színe, a felhők széle, valamint az „írisz” (növény), az „írisz rekeszizom” és még az „írisz” szó is - az írisz gyulladása. a szem.
Ródium (Rh)
Az elemet 1803-ban fedezte fel az angol kémikus, W.G. Wollaston. Az őshonos dél-amerikai platinát aqua regiában oldotta fel; a savfelesleg marónátronnal történő semlegesítése, valamint a platina és a palládium szétválasztása után rózsaszínes-vörös oldat, nátrium-hexaklorid Na 3 RhCl 6 maradt, amelyből az új fémet izolálták. Neve a görög „rhodon” - rózsa és a „rodeos” - rózsa-vörös szavakból származik.
Prazeodímium és neodímium (Pr), (Nd)
1841-ben K. Mosander felosztotta a Lantát új föld” két új „földre” (azaz oxidokra). Az egyik lantán-oxid volt, a másik nagyon hasonlított hozzá, és „didímiának” nevezték - a görög nyelvből. "didimos" - iker. 1882-ben K. Auer von Welsbachnak sikerült a didímét alkotóelemekre bontania. Kiderült, hogy ez két új elem oxidjainak keveréke. Egyikük zöld sókat adott, és Auer ezt az elemet prazeodímiumnak, azaz „zöld ikernek” nevezte (a görög „prazidos” szóból - világoszöld). A második elem rózsaszín-vörös sókat adott, neodímiumnak, azaz „új ikernek” nevezték.
Tallium (Tl)
William Crookes angol fizikus és kémikus, a spektrális analízis specialistája, aki a kénsavgyártásból származó hulladékot tanulmányozza, 1861. március 7-én ezt írta egy laboratóriumi folyóiratban: „A zöld vonal a spektrumban, amelyet a szelénmaradványok néhány része adja. , nem a kénnek, szelénnek, tellúrnak köszönhető; nincs kalcium, bárium, stroncium; nincs benne kálium, nátrium, lítium." Valójában ez egy új elem sora volt, amelynek neve a görögből származik thallos- zöld ág. Crookes romantikusan közelítette meg a névválasztást: „Azért választottam ezt a nevet, mert a zöld vonal megfelel a spektrumnak, és visszaadja a növények jelenlegi friss színének sajátos fényességét.”
Indium (in)
1863-ban a German Journal of Practical Chemistry-ben üzenet jelent meg a Freibergi Bányászati Akadémia Kohászati Laboratóriumának igazgatójától, F. Reichtől és asszisztensétől, T. Richtertől egy új fém felfedezéséről. Miközben a helyi polifémes érceket elemezték az újonnan felfedezett tallium után, a szerzők "egy eddig ismeretlen indigókék vonalat vettek észre". Aztán ezt írják: "Olyan fényes, éles és stabil kék vonalat kaptunk a spektroszkópban, hogy habozás nélkül arra a következtetésre jutottunk, hogy létezik egy ismeretlen fém, amelyet indiumnak javasolunk." Az új elem sókoncentrátumait spektroszkóp nélkül is észlelték - az égő lángjának intenzív kék színe alapján. Ez a szín nagyon hasonlított az indigófesték színére, innen ered az elem neve is.
Rubídium és cézium (Rb), (Cs)
Ezek az első kémiai elemek, amelyeket a 18. század 60-as éveinek elején fedezett fel G. Kirchhoff és R. Bunsen az általuk kifejlesztett módszerrel - spektrális elemzéssel. A cézium a spektrum fényes kék vonaláról kapta a nevét (lat. caesius - kék), a rubídium - a spektrum vörös részének vonalairól (lat. rubidus- piros). Az új alkálifémek több gramm sójának előállításához a kutatók 44 tonna durkheimi ásványvizet és több mint 180 kg lepidolit ásvány-alumínium-szilikát összetételű K(Li,Al) 3 (Si,Al) 4 O 10 (F,OH) összetételt dolgoztak fel. 2, amelyben a rubídium és a cézium-oxidok szennyeződésként vannak jelen.
Hidrogén és oxigén (H), (O)
Ezek a nevek szó szerinti fordítások oroszra latinból ( hidrogén, oxigénium). Ezeket A.L. találta ki. Lavoisier, aki tévesen azt hitte, hogy az oxigén „szül” minden savat. Logikusabb lenne az ellenkezője: az oxigént hidrogénnek nevezni (ez az elem is „vizet szül”), a hidrogént pedig oxigénnek, mivel ez minden sav része.
Nitrogén (N)
Az elem francia nevét (azote) szintén Lavoisier javasolta - a görög „a” negatív előtagból és a „zoe” szóból - élet (ugyanaz a gyökér a „zoológia” szóban és származékaiban - állatkert, állatföldrajz, zoomorfizmus , zooplankton, zootechnikus stb.). Az elnevezés nem teljesen találó: a nitrogén, bár légzésre nem alkalmas, az élethez feltétlenül szükséges, hiszen minden fehérjéhez, bármely nukleinsavhoz hozzátartozik. Ugyanaz a származás és a német név Stickstoff- fulladást okozó anyag. Az „azo” gyök megtalálható az „azid”, „azovegyület”, „azin” és mások nemzetközi elnevezéseiben. De a latin nitrogénés angolul nitrogén a héber „neter” szóból származik (görög „nitron”, lat. nitrum); Így nevezték az ókorban a természetes lúgot szódának, később pedig salétromnak.
Rádium és radon (Ra), (Rn)
Az összes nyelvre jellemző nevek latin szavakból származnak sugár- gerenda és radiare- sugarakat bocsát ki. A rádiumot felfedező Curie-k így azonosították a láthatatlan részecskéket kibocsátó képességét. A „rádió”, a „sugárzás” szavak és számtalan származéka azonos eredetű (több mint száz ilyen szó található a szótárakban, az elavult radiogramoktól a modern radioökológiáig). Amikor a rádium bomlik, radioaktív gáz szabadul fel, amit rádium emanációnak neveznek (a latin. emanatio- kiáramlás), majd radon - számos más nemesgáz nevének analógiájával (vagy talán egyszerűen az E. Rutherford által javasolt angol név kezdő és utolsó betűivel) rádium emanáció).
Aktínium és protaktinum (Ac), (Pc)
Ezeknek a radioaktív elemeknek a nevét a rádium analógiájával adják: görögül „aktis” - sugárzás, fény. Bár a protaktiniumot 1917-ben fedezték fel, vagyis 18 évvel később, mint az aktínium, az aktinium úgynevezett természetes radioaktív sorozatában (amely az urán-235-tel kezdődik), a protaktinium korábban található; innen a neve: a görög „protos” szóból - első, kezdőbetű, kezdőbetű.
Asztatin (At)
Ezt az elemet 1940-ben nyerték mesterségesen úgy, hogy a bizmutot alfa-részecskékkel sugározták be ciklotronon. De csak hét évvel később a felfedezés szerzői – amerikai fizikusok, D. Corson, K. Mackenzie és E. Segre – a görög „astatos” szóból származó nevet adtak ennek az elemnek – instabil, ingatag (a „statika” szó és sok származékainak ugyanaz a gyöke) . Az elem leghosszabb életű izotópjának felezési ideje 7,2 óra – akkor úgy tűnt, hogy ez nagyon rövid.
Argon (Ar)
Egy nemesgáz, amelyet 1894-ben izoláltak a levegőből angol tudósok, J.W. Rayleigh és W. Ramsay semmilyen anyaggal nem reagált, ezért kapta a nevét - a görög "a" negatív előtagból és az "ergon" szóból - üzlet, tevékenység. Ebből a gyökérből származik az energia rendszeren kívüli egysége, az erg, valamint az „energy”, „energetic” stb. szavak. Az „argon” nevet Mazan vegyész javasolta, aki a British Association oxfordi ülésének elnöke volt. Rayleigh és Ramsay egy új gáz felfedezéséről tartott előadást 1904-ben Ramsay kémikus kémiai Nobel-díjat kapott az argon és más nemesgázok légköri felfedezéséért, John William Strett (Lord Rayleigh) fizikus pedig ugyanebben az évben, sőt ugyanezért a felfedezésért megkapta a Fizikai Nobel-díj. Valószínűleg ez az egyetlen ilyen eset. Míg az argon megerősíti nevét, egyetlen stabil vegyületet sem sikerült előállítani, kivéve a zárványvegyületeket fenollal, hidrokinonnal és acetonnal.
Platina (Pt)
Amikor a spanyolok Amerikában a 16. század közepén megismerkedtek egy új, az ezüsthöz nagyon hasonló fémmel (spanyolul plata), kissé lekicsinylő nevet adtak neki platina, szó szerint „kis ezüst”, „kis ezüst”. Ez a platina (kb. 1770 °C) tűzállóságával magyarázható, amelyet nem lehetett újraolvasztani.
Molibdén (Mo)
A „molibdosz” görögül ólmot jelent, innen ered a latin molibdén- így hívták a középkorban az ólomfényt PbS-nek, a ritkább molibdénfényt (MoS 2) és más hasonló ásványokat, amelyek fekete nyomot hagytak a papíron, beleértve a grafitot és magát az ólmot is (nem hiába a ceruza németül hívják - Bleistift, azaz ólomrúd). A 18. század végén új fémet izoláltak a molibdénfényből (molibdenit); Y.Ya javaslatára. Berzelius molibdénnek nevezte.
Volfrám (W)
Németországban régóta ismertek egy ilyen nevű ásványt. Ez egy vegyes vas-mangán-volframát x FeWO 4 y MnWO4. Nehézsége miatt gyakran összetévesztették az ónérccsel, amelyből azonban fémeket nem olvasztottak ki. A bányászok gyanakvó hozzáállása ehhez az újabb „ördögi” érchez (emlékezzünk a nikkelre és a kobaltra) tükröződött a nevében: Farkas németül - farkas. Mi az a "kos"? Van ez a verzió: ónémet nyelven Ramm- kos; kiderül, hogy a gonosz szellemek „felfalják” a fémet, mint a farkas a kost. De feltételezhetünk mást is: a német nyelv délnémet, svájci és osztrák dialektusában még mindig van ige rahm(olvasd: „kos”), ami azt jelenti, hogy „lefölözzük le a tejszínt”, „vegye ki magának a legjobb részt”. Aztán a „farkasok - bárányok” helyett egy másik változatot kapunk: a „farkas” a legjobb részt veszi magának, és a bányászoknak nem marad semmi. A „tungsten” szó németül és oroszul van, míg az angolban és a franciában csak a képletekben szereplő W jel és a wolframit ásvány neve maradt meg belőle; más esetekben - csak „volfrám”. Így nevezte egykor Berzelius azt a nehéz ásványt, amelyből K.V. Scheele 1781-ben izolálta a volfrám-oxidot. svéd tung sten- nehéz kő, innen ered a fém neve. Egyébként ezt az ásványt (CaWO 4) később a tudós tiszteletére scheelitnek nevezték el.
Cink (Zn)
M. Lomonoszov a fémet a némettől cinknek nevezte el Zink. Valószínűleg ez a szó az ókori germánból származik tinka- fehér, mert a legelterjedtebb cinkvegyület a ZnO-oxid (az alkimisták „filozófiai gyapja” – talán ez a furcsa tulajdonság a megjelenés ez az oxid) fehér. Talán ez a szó a német zinke szóból származik ("fogszerű", "végén kihegyezett" (németül "fog" - zahn), mert természetes formájában, kristályokban a cink-oxid valóban úgy néz ki, mint egy fémtű. Perzsa nyelven , a seng „követ” jelent – ez a szó a modern cink lehetséges ősének is tekinthető.

Foszfor (P)
Amikor Henning Brand hamburgi alkimista 1669-ben felfedezte a foszfor fehér módosulatát, lenyűgözte annak fénye a sötétben (valójában nem a foszfor világít, hanem a gőzei, amikor a légköri oxigén oxidálja). Az új anyag nevet kapott, amely görögül azt jelenti, hogy „fényt hordoz”. Tehát a "közlekedési lámpa" nyelvileg ugyanaz, mint a "foszfor". A görögök egyébként Phosphorosnak nevezték a reggel Vénuszt, ami a napfelkeltét jelezte előre.
Arzén (As)
Az orosz név valószínűleg az egerek mérgezésére használt méreghez kapcsolódik, a szürke arzén színe egérre emlékeztet. latin arsenicum a görög „arsenikos”-hoz nyúlik vissza - férfias, valószínűleg ennek az elemnek a vegyületeinek erős hatása miatt. A fikciónak köszönhetően mindenki tudja, mire használták.
Antimon (Sb)
A kémiában ennek az elemnek három neve van. orosz szó Az „antimon” a török „surme” szóból származik - az ókorban a szemöldök dörzsölése vagy feketítése, ehhez a festék finomra őrölt fekete antimon-szulfid Sb 2 S 3 („Te böjtölj, ne sötétítsd el a szemöldöködet.” - M. Tsvetaeva) ). az elem latin neve ( stibium) a görög „stibi” szóból származik – egy kozmetikai termék a szemhéjfestékre és a szembetegségek kezelésére. Az antimonsav sóit antimonitoknak nevezik, a név valószínűleg a görög „antemon”-hoz köthető - egy virág - a virágokhoz hasonló antimonfényű Sb 2 S 2 tű alakú kristályok összenövése.
bizmut (Bi)
Ez valószínűleg a német korrupciója" Weisse Masse„- fehér massza, vöröses árnyalatú fehér bizmutrögök ősidők óta ismertek. Egyébként a nyugat-európai nyelvekben (a német kivételével) az elem neve „b”-vel kezdődik ( bizmut). Gyakori jelenség a latin „b” helyettesítése az orosz „v”-vel Ábel- Ábel, Bazsalikom- Vaszilij, baziliszkusz- baziliszkusz, Barbara- Varvara, barbárság- barbárság, Benjámin- Benjamin, Bartholomew- Bartholomew, Babilon- Babilon, Bizánc- Bizánc, Libanon- Libanon, Líbia- Líbia, Baal- Baál, ábécé- ábécé... Talán a fordítók azt hitték, hogy a görög „béta” az orosz „v”.
Lítium (Li)
Amikor 1817-ben Berzelius tanítványa, a svéd vegyész I.A. Arfvedson egy új, „még ismeretlen természetű tűzálló lúgot” fedezett fel az egyik ásványban, és tanára azt javasolta, hogy a görög „lithos” szóból „lition”-nak nevezze el, mivel ez a lúg, ellentétben a már ismert nátrium- és káliumlúggal; , először a kövek „királyságában” fedezték fel. Az elemhez a „lítium” nevet rendelték. Ugyanez a görög gyök található a „litoszféra”, „litográfia” (kőforma lenyomata) és mások szavakban.
Nátrium (Na)
A 18. században a „nátron” nevet az „ásványi lúghoz” – a marószódához – rendelték. Ma a kémiában a „nátriummész” nátrium- és kalcium-hidroxidok keveréke. Tehát a nátrium és a nitrogén – két teljesen különböző elem – úgy tűnik, hogy van valami közös (latin nevük alapján nitrogénÉs nátrium) eredete. angol és francia elemnevek ( nátrium) valószínűleg az arab „suvwad” szóból származik - ezt nevezték az arabok tengerparti tengeri növénynek, amelynek hamu a legtöbb más növénytől eltérően nem kálium-karbonátot, hanem nátrium-karbonátot, azaz szódát tartalmaz.
Kálium (K)
Arabul az „al-kali” növényi hamuból, azaz kálium-karbonátból nyert termék. Eddig a vidéki lakosok ezt a hamut használták a növények káliummal való táplálására; például a napraforgóhamu több mint 30% káliumot tartalmaz. Angol elemnév kálium, mint az orosz „káli”, a germán csoport nyelveiből kölcsönzik; németül és hollandul hamu- hamu, edény- az edény, vagyis a hamuzsír „hamu fazékból”. Korábban a kálium-karbonátot úgy nyerték, hogy az extraktumot kádakban bepárolták a hamuból.
Kalcium (Ca)
Rómaiak egyszóval égetett ércanyag maradéka(nemzetség esete calcis) minden puha kövnek nevezik. Idővel ezt a nevet csak a mészkőhöz rendelték (nem ok nélkül kréta angolul - kréta). Ugyanezt a szót használták a mészre, amely a kalcium-karbonát égetésének terméke. Az alkimisták magát az égetési folyamatot kalcinálásnak nevezték. A szódabikarbóna tehát egy vízmentes nátrium-karbonát, amelyet Na 2 CO 3 ·10H 2 O kristályos karbonát kalcinálásával nyernek. A kalciumot először 1808-ban G. Davy nyert mészből, ő adta a nevet is az új elemnek. A kalcium a számológép rokona: a rómaiaknál számítás(kicsinyítője égetett ércanyag maradéka) - apró kavics, kavics. Az ilyen kavicsokat egyszerű számításokhoz használták egy résekkel ellátott tábla segítségével - egy abakuszt, az orosz abakusz ősét. Mindezek a szavak nyomot hagytak az európai nyelveken. Igen, angolul égetett ércanyag maradéka- vízkő, hamu és mész; meszes festék- mészhabarcs meszeléshez; kalcinálás- kalcinálás, pörkölés; számítás- vesekő, hólyagkő, valamint kalkulus (differenciál- és integrál) a felsőbb matematikában; kiszámítani- számolni, számolni. A modern olasz nyelvben, amely a legközelebb áll a latinhoz, calcolo egyben számítás és kő.
Bárium (Ba)
1774-ben a svéd vegyészek K.V. Scheele és Yu.G. Gan új „földet” izolált a nehéz ásványból (BaSO 4), amelyet baritnak neveztek; görögül a „baros” azt jelenti, hogy nehéz, a „baris” azt jelenti, hogy nehéz. Amikor 1808-ban elektrolízissel új fémet izoláltak erről a „földről” (BaO), azt báriumnak nevezték el. Tehát a báriumnak is vannak váratlan és gyakorlatilag nem rokon „rokonai”; köztük - barométer, barográf, nyomáskamra, bariton - alacsony („nehéz”) hang, barionok - nehéz elemi részecskék.
Bór (B)
Az arabok a „burak” szót sok sónak nevezték. fehér, vízben oldódik. Ezen sók egyike a bórax, egy természetes nátrium-tetraborát Na 2 B 4 O 7 10H 2 O. A bóraxból 1702-ben kalcinálással nyerték ki a bórsavat, 1808-ban pedig L. Gay-Lussac és L. Tenard egymástól függetlenül A. új elemet, a bórt izolálták egy baráttól.
Alumínium (Al)
A fizikus és kémikus fedezte fel X.K. Oersted 1825-ben. A név latinból származik alumínium(nemzetség esete alumínium) - az úgynevezett timsó (kettős kálium-alumínium-szulfát KAl(SO 4) 2 · 12H 2 O), szövetfestéskor maróanyagként használták. A latin név valószínűleg a görög „halme” szóra nyúlik vissza – sóoldat, sóoldat.
Lantán (La)
1794-ben J. Gadolin finn kémikus új „itriumföldet” fedezett fel a cerit ásványában. Kilenc évvel később ugyanabban az ásványban J. Berzelius és W. Hisinger egy másik „földet” talált, amelyet cériumnak neveztek. Ezekből a „földekből” később számos ritkaföldfém elem oxidjait izolálták. Az egyiket, amelyet 1839-ben fedeztek fel Berzelius javaslatára, lantánnak hívták - a görög nyelvből. „lantanán” – elrejteni: az új elem évtizedekig „bújt” a vegyészek elől.
Szilícium (Si)
Az elem orosz neve, amelyet G.I. adott neki. Hess 1831-ben, az ószláv „kovakő” szóból származik, amely kemény kő. Ez a latin eredete szilícium(és nemzetközi "szilikát"): silex- kő, macskakő, valamint szikla, szikla. A nevek összefüggenek egymással - elvégre lágy sziklák nincsenek...
Cirkónium (Zr)
A név a perzsa „tsargun” szóból származik - arany színűre festve. A cirkon ásvány (ZrSiO 4) egyik fajtája - a jácint drágakő - ilyen színű. A cirkónium-dioxidot ("cirkonföld") 1789-ben a német kémikus, M.G. izolálta a ceyloni cirkonból. Klaproth.
Technécium (Tc)
A név ennek az elemnek a mesterséges előállítását tükrözi: 1936-ban kis mennyiségű technéciumot szintetizáltak molibdén besugárzásával egy ciklotronban deutériummagokkal. A „technetos” görögül „mesterséges”
Következtetés
Ez a munka és az elkészítéséhez felhasznált anyagok felhasználhatók a vizsgákra való felkészülésre, a tanult elemek szokványos módszerhez képest szokatlan szögből történő vizsgálatára, vagy olimpiára való felkészülésre, ahol elmélyült tudás bizonyítása szükséges. az alany.
Jelenleg nincs általánosan elfogadott etimológia szerinti felosztás, ezért a sajátunkat javasoljuk. Az elemeket a név tárgya szerint 5 csoportba osztottuk: helynevek; az azokat felfedező kutatókról elnevezett elemek; mitológiai gyökerű elemek; tulajdonságaikról vagy megnyitásuk módjáról elnevezett elemek.
Volt azonban több olyan elem is, mint plutónium, neptunium, urán, amelyeket problémás volt bármely csoporthoz rendelni: egyrészt ezek az ősi istenek nevei, és logikus, hogy a hozzájuk kapcsolódó elemeknek tulajdonítsuk őket. mítoszok. De másrészt ezek a bolygók nevei, és célszerű helynévi elemek közé sorolni őket.
Az egyes csoportokat illetően a következő következtetéseket vontuk le.
Helynévelemek szerint: ezeket az elemeket több okból is földrajzi objektumokról nevezték el: vagy ez volt az a hely, ahol az elemet közvetlenül felfedezték, vagy a tudós kívánta jelezni ennek a helynek a jelentőségét saját maga és a tudomány számára. Ezek az elnevezések korábban relevánsabbak voltak, mint ma, mivel a modern időkben felfedezett elemek nem léteznek a természetben - nagy nukleáris kutatóintézetekben szintetizálják őket.
Mitológiai hősökről elnevezett elemek esetében: ezeknek az elemeknek a neve utalást tartalmaz tulajdonságaikra. De miért nem tudták a tudósok egyszerűen megnevezni az elemeket tulajdonságaik alapján, hanem úgy döntöttek, hogy néhány ősi hőst a név szerint neveznek meg? Arra a következtetésre jutottunk, hogy a tudósok a 18-19. nagyon sokoldalú és művelt emberek voltak, akiket a tudás különféle területei érdekeltek, de nem korlátozódtak a szakterületükre, ami sajnos manapság nagyon gyakori.
A tudósokról elnevezett elemekről: Azt vettük észre, hogy nem sok elemet neveztek el tudósokról. Úgy tűnik, be tudományos társaság Nem szokás megörökíteni magát a saját felfedezés nevében. Ráadásul csak néhány elemet, például a mendeleviumot nevezték el kémikusokról. Ezen elemek többségét fizikusokról nevezték el. És általában, ahhoz, hogy egy elemet annak tiszteletére nevezzenek el, aki felfedezte, el kell telnie egy kis időnek, hogy az emberek értékelni tudják a felfedezést, és csak ezután örökítsék meg a kutatót az elem nevében.
Érdekes, hogy ha korábban egy tudós maga találhatta ki egy elem nevét, vagy egyeztethette ezt a kérdést az illetékes hatóságokkal, most az új elemek szintézisének bonyolultsága miatt egész intézeteknek van joga elnevezni egy elemet. a felfedezés szerzői. Most már létezik egy speciális szervezet - IUPAC (angolul) - International Union of Pure and Applied Chemistry -, amely az elemnómenklatúra kérdéseivel foglalkozik. Tudósok teljes találkozói különböző országokban, ahol megvitatják az új elem neveit, és végül megszületik a döntés. Természetesen az elem elnevezésében elsőbbséget élvez az az ország, amelyik felfedezte.
Azoknál az elemeknél, amelyek nevéhez a tulajdonságaik társulnak: ilyen elnevezést kaphatnak az elemek külső jelek alapján és a megfelelő anyagon végzett első reakciók után. Most már nem adnak ilyen elnevezéseket az elemeknek, mivel lehetetlen az elemek fizikai vagy kémiai tulajdonságait tanulmányozni, mert speciális nukleáris kutatóintézetekben szintetizálják több atomnyi mennyiségben.
Hivatkozások
1. I.V. Petryanov-Sokolov „Kémiai elemek népszerű könyvtára” 2 részben (Moszkva, Nauka, 1983)
2. J. Emsley „Elemek” (Moszkva, Mir, 1993)
3. Kondrashov A.P. „Ki kicsoda a klasszikus mitológiában” (Moszkva, Ripol Classic, 2002)
4. Leenson I.A. – Honnan származik a neved? cikk a „Kémia és Élet” folyóiratban (Moszkva, 3. szám (2004))
5. N.A. Figurovsky "Az elemek felfedezése és nevük eredete" (Moszkva, Nauka, 1970)
A zseniális orosz kémikus D. I. Mengyelejevet egész életében az ismeretlenség megértésének vágya jellemezte. Ez a vágy, valamint a legmélyebb és legszélesebb körű tudás, valamint az összetéveszthetetlen tudományos intuíció lehetővé tette Dmitrij Ivanovics számára, hogy kidolgozza a kémiai elemek tudományos osztályozását - a periódusos rendszert híres táblázata formájában.
D. I. Mengyelejev kémiai elemek periodikus rendszere egy nagy házként képzelhető el, amelyben az ember által ismert összes kémiai elem „együtt él”. A periódusos rendszer használatához tanulmányoznia kell a kémiai ábécét, azaz a kémiai elemek jeleit.
Segítségükkel megtanul szavakat - kémiai képleteket - írni, és ezek alapján tud majd mondatokat - kémiai reakcióegyenleteket írni. Minden kémiai elemet a saját kémiai jele vagy szimbóluma jelöl, amely a kémiai elem nevével együtt szerepel D. I. Mengyelejev táblázatában. J. Berzelius svéd kémikus javaslatára a legtöbb esetben a kémiai elemek latin nevének kezdőbetűit vették át szimbólumként. Így a hidrogént (latin neve Hydrogenium - hydrogenium) H betűvel ("hamu"), oxigént (latin neve Oxygenium - oxigénium) - O betűvel ("o"), szénnel (latin neve Сarboneum - carboneum) jelöljük. ) - a C betűvel (olvassa: "tse").
Számos további kémiai elem latin neve C betűvel kezdődik: kalcium (
Kalcium), réz (Cuprum), kobalt (Cobaltum) stb. Megkülönböztetésük érdekében I. Berzelius azt javasolta, hogy a latin név kezdőbetűjéhez adják hozzá a név egyik következő betűjét. Így a kalcium kémiai jelét Ca (értsd: „kalcium”), réz - Cu (értsd: „cuprum”), kobalt - Co (értsd „kobalt”) szimbólummal írják.
Egyes kémiai elemek nevei az elemek legfontosabb tulajdonságait tükrözik, például a hidrogén - amely vizet termel, oxigén -, amely savakat termel, foszfor - amely fényt hordoz (20. ábra) stb.
Rizs. 20.
D. I. Mengyelejev periódusos rendszerének 15. számú eleme nevének etimológiája
Más elemeket a Naprendszer égitesteiről vagy bolygóiról neveztek el - szelén és tellúr (21. ábra) (a görög Selene - Hold és Telluris - Föld szóból), urán, neptunium, plutónium.

Rizs. 21.
D. I. Mengyelejev periódusos rendszerének 52. számú eleme nevének etimológiája
Egyes nevek a mitológiából származnak (22. kép). Például tantál. Ez volt a neve Zeusz szeretett fiának. Az istenek elleni bűncselekményekért Tantalust szigorúan megbüntették. Nyakig felállt a vízben, és lédús, illatos gyümölcsű ágak lógtak rajta. Amint azonban inni akart, elfolyt róla a víz, amint csillapítani akarta az éhségét, a gyümölcsök felé nyújtotta a kezét - az ágak oldalra tértek; A tantál ércektől való elkülönítésére törekvő vegyészek nem kevesebb kínt tapasztaltak.

Rizs. 22.
D. I. Mengyelejev periódusos rendszerének 61. számú eleme nevének etimológiája
Egyes elemeket a világ különböző államairól vagy részeiről neveztek el. Például germánium, gallium (Franciaország régi neve Gallium), polónium (Lengyelország tiszteletére), skandium (Skandinávia tiszteletére), francium, ruténium (Ruténium Oroszország latin neve), európium és americium. Íme a városokról elnevezett elemek: hafnium (Koppenhága után), lutécium (régi időkben Párizst Lutetiumnak hívták), berkelium (az USA-beli Berkeley városa után), ittrium, terbium, erbium, itterbium (ezek nevei az elemek Ytterbyből származnak - kisváros Svédországban, ahol először fedeztek fel ezen elemeket tartalmazó ásványt, a dubniumot (23. ábra).

Rizs. 23.
D. I. Mengyelejev periódusos rendszerének 105. számú eleme nevének etimológiája
Végül az elemek nevei nagy tudósok neveit örökítik meg: curium, fermium, einsteinium, mendelevium (24. ábra), Lawrencium.

Rizs. 24.
D. I. Mengyelejev periódusos rendszerének 101. számú eleme nevének etimológiája
Minden kémiai elem hozzá van rendelve a periódusos rendszerhez, az összes elem közös „házához”, saját „lakásához” - egy szigorúan meghatározott számú cellához. Ennek a számnak a mélyebb jelentése a kémia további tanulmányozása során fog feltárulni. Ezen „apartmanok” emeleteinek száma is szigorúan megoszlik - az elemek „élésének” időszakai. Egy elem sorszámához (a „lakás” számához) hasonlóan a periódus (“emelet”) száma is tele van létfontosságú információkat kémiai elemek atomjainak szerkezetéről. Vízszintesen - „szintek” - a periódusos rendszer hét periódusra oszlik:
- Az 1. periódus két elemet foglal magában: hidrogén H és hélium He;
- A 2. periódus lítiummal kezdődik és neon Neonnal (8 elem) végződik;
- A 3. periódus nátrium-Na-val kezdődik és argon Ar-val (8 elem) végződik.
Az első három periódust, amelyek mindegyike egy sorból áll, kis periódusoknak nevezzük.

A 4., 5. és 6. periódusok két sor elemet tartalmaznak, ezeket nagy periódusoknak nevezzük; A 4. és 5. periódus egyenként 18, a 6. - 32 elemet tartalmaz.

A 7. periódus befejezetlen, egyelőre csak egy sorból áll.
Ügyeljen a periódusos rendszer „alagsoraira” - 14 ikerelem „él” ott, amelyek tulajdonságaiban a lantán La-hoz, mások az aktinium Ac-hez hasonlítanak, amelyek a táblázat felső „szintjein” képviselik őket: 6. és 7. periódus.
Függőlegesen a hasonló tulajdonságokkal rendelkező „lakásokban” „élő” kémiai elemek egymás alatt helyezkednek el függőleges oszlopokban - csoportokban, amelyekből nyolc van D. I. Mengyelejev táblázatában.
Mindegyik csoport két alcsoportból áll - fő és másodlagos. A rövid és hosszú periódusok elemeit egyaránt tartalmazó alcsoportot fő alcsoportnak vagy A csoportnak nevezzük. A csak hosszú periódusok elemeit tartalmazó alcsoportot másodlagos alcsoportnak vagy B csoportnak nevezzük. Így az I. csoport fő alcsoportja. (IA csoport) magában foglalja a lítiumot, a nátriumot, a káliumot, a rubídiumot és a franciumot a lítium Li alcsoportja; ennek a csoportnak egy oldalsó alcsoportját (IB csoport) a réz, ezüst és arany alkotja - ez a réz réz alcsoportja.

D. I. Mengyelejev táblázatának rövid periódusnak nevezett formáján kívül (a tankönyv légylapján látható) sok más forma is létezik, például a hosszú periódusú változat.
Ahogyan a Lego játék elemeiből egy gyerek rengeteg különféle tárgyat tud megkonstruálni (lásd 10. ábra), úgy a természet és az ember kémiai elemekből teremtette meg a minket körülvevő anyagok sokféleségét. Egy másik modell még egyértelműbb: ahogy az orosz ábécé 33 betűje különféle kombinációkat, több tízezer szót alkot, úgy 114 kémiai elem különböző kombinációkban több mint 20 millió különböző anyagot hoz létre.
Próbáld megtanulni a szavak – kémiai képletek – keletkezésének törvényeit, és akkor megnyílik előtted az anyagok világa a maga színes sokszínűségében.
De ehhez először tanulja meg a betűket - a kémiai elemek szimbólumait (1. táblázat).
1. táblázat
Néhány kémiai elem neve

Kulcsszavak és kifejezések
- D. I. Mengyelejev kémiai elemek periódusos rendszere (táblázat).
- Kis és nagy időszakok.
- Csoportok és alcsoportok - fő (A csoport) és másodlagos (B csoport).
- A kémiai elemek szimbólumai.
Számítógéppel végzett munka
- Érintkezés elektronikus jelentkezés. Tanulmányozza át az óra anyagát, és hajtsa végre a kijelölt feladatokat.
- Keressen az interneten email címeket, amely további forrásként szolgálhat a bekezdésben szereplő kulcsszavak és kifejezések tartalmának feltárására. Ajánlja fel a tanárnak segítségét egy új óra előkészítésében - készítsen jelentést a következő bekezdés kulcsszavairól és kifejezéseiről.
Kérdések és feladatok
- Szótárak segítségével (etimológiai, enciklopédikus és kémiai szakkifejezések) nevezze meg a legfontosabb tulajdonságokat, amelyek a kémiai elemek elnevezésében tükröződnek: bróm Br, nitrogén N, fluor F.
- Magyarázza el, hogy a titán és a vanádium kémiai elemek neve hogyan tükrözi az ókori görög mítoszok hatását!
- Miért az arany latin neve Aurum (aurum) és ezüst - Argentum (argentum)?
- Mesélje el egy választott kémiai elem felfedezésének történetét, és magyarázza el nevének etimológiáját.
- Írja fel a „koordinátákat”, azaz a helyét D. I. Mengyelejev periódusos rendszerében (elemszám, periódusszám és típusa - nagy vagy kicsi, csoportszám és alcsoport - fő vagy mellék), a következő kémiai elemekhez: kalcium, cink. , antimon, tantál, európium.
- Oszd három csoportba az 1. táblázatban felsorolt kémiai elemeket a „kémiai szimbólum kiejtése” alapján. Segíthet-e ennek a tevékenységnek a kémiai szimbólumok emlékezésében és az elemek szimbólumainak kiejtésében?